Vous ne le savez peut être pas encore, mais sur Excel vous avez la possibilité de faire toutes vos statistiques. Et ça, c’est bien pratique quand on rédige une thèse, un mémoire ou un article scientifique. (Je n’ai aucun conflit d’intérêt à déclarer avec la société Microsoft®)
Vous ne le savez peut être pas encore, mais sur Excel vous avez la possibilité de faire toutes vos statistiques. Et ça, c’est bien pratique quand on rédige une thèse, un mémoire ou un article scientifique. (Je n’ai aucun conflit d’intérêt à déclarer avec la société Microsoft®)
Présentation d’excel
C’est quoi, Excel ?
Excel est un tableur créé par la société Microsoft®. Il a été conçu sous forme de cellules repérées grâce à l’adressage (Cf. « adressage »).
Il est très pratique pour faire des calculs, des tableaux, et des graphiques.
La sémAntique Excel
Un document Excel est appelé classeur.
Chaque classeur possède trois feuilles de calcul par défaut, on peut les voir en bas à gauche du classeur. On peut ajouter des feuilles à sa guise en cliquant sur ce bouton :

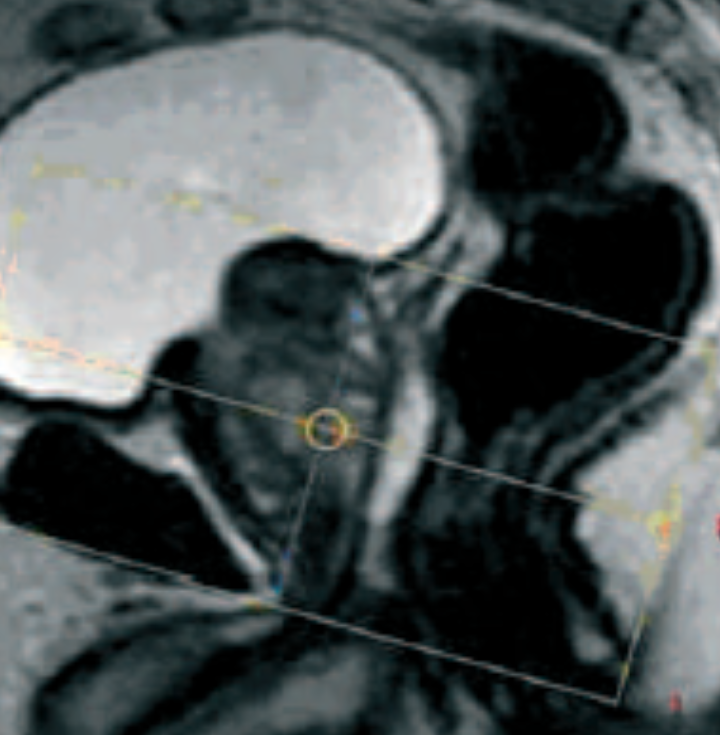
L’adressage
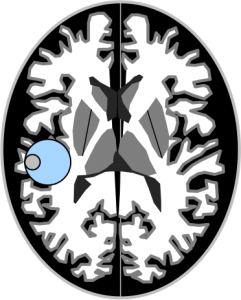
Sur l’image ci-après la cellule F7.
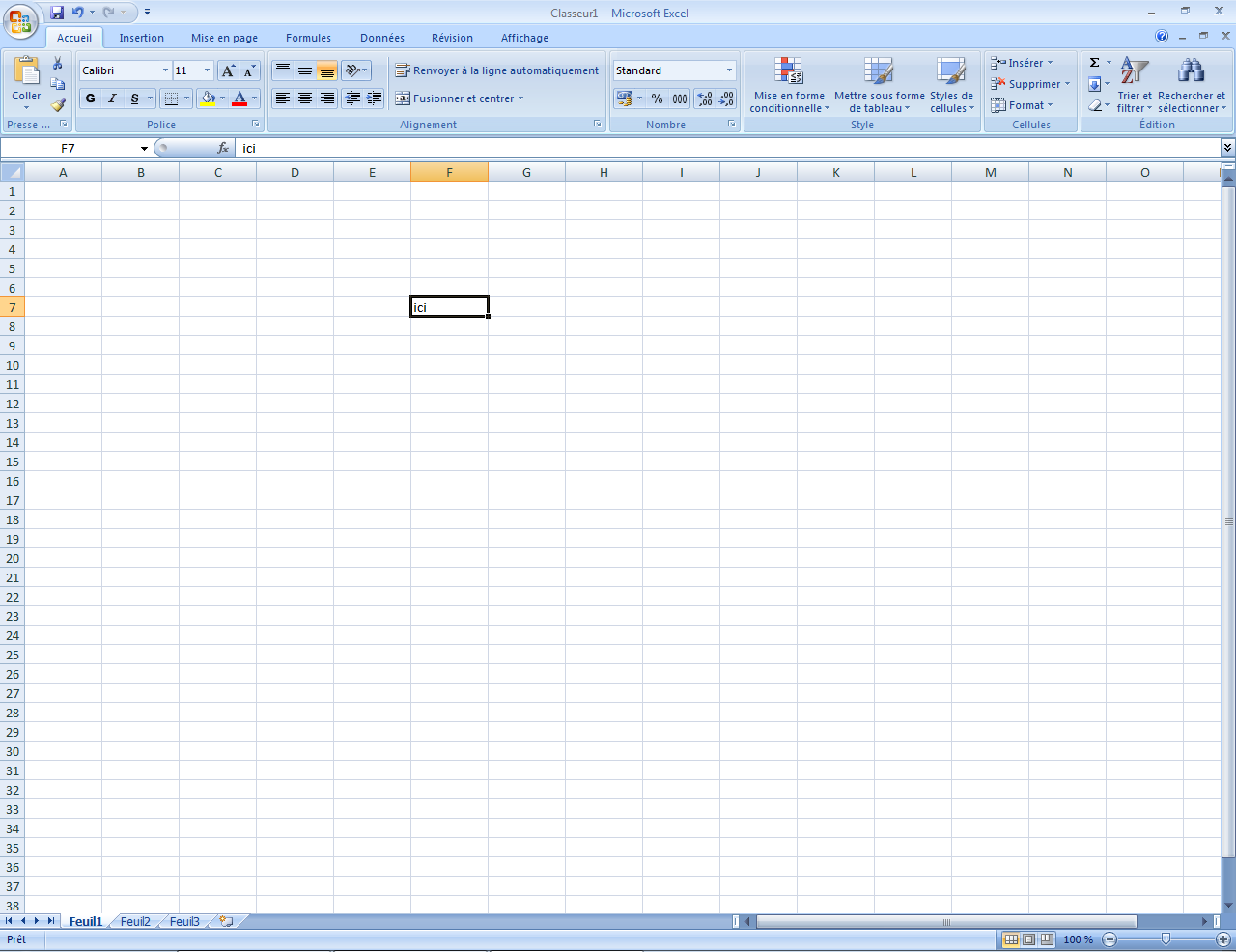
Lorsque vous êtes dans une cellule, ses coordonnées (par exemple, F7) se colorient en orange dans les barres (en haut et à gauche).
Astuce Excel
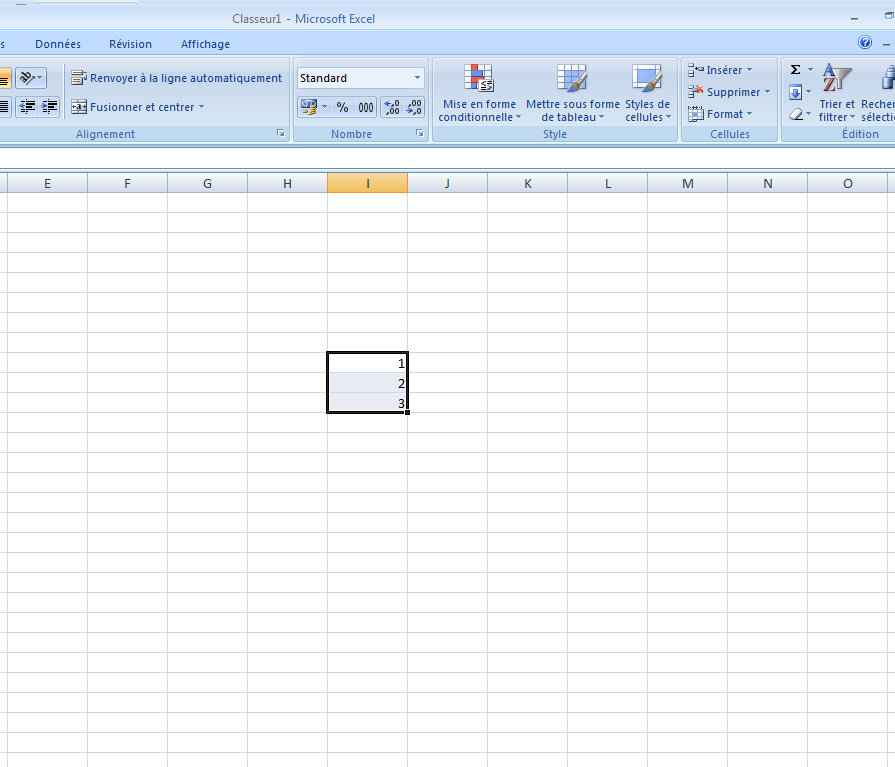
Imaginons que vous vouliez remplir rapidement une colonne avec une succession de chiffres (ou de dates). Rentrez les deux ou trois premiers.
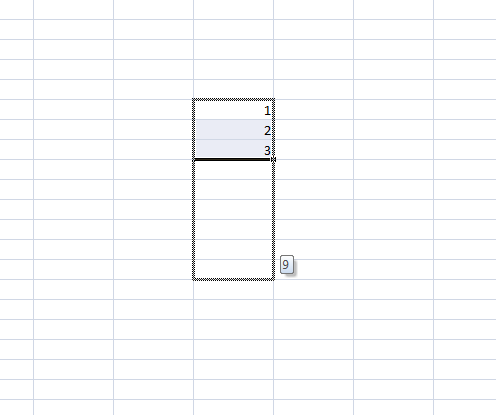
Sélectionnez les cases à répéter. Cliquez sur la petite croix (le petit +) en bas à droite des cases sélectionnées. Tirez vers le bas. Relâchez.
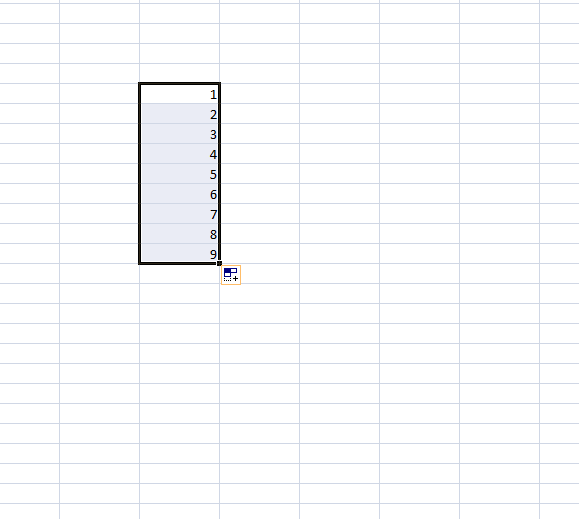
Vos cellules sont remplies automatiquement.
Cette astuces marche avec de multiples combinaisons. A vous de tester.
Les formules Excel
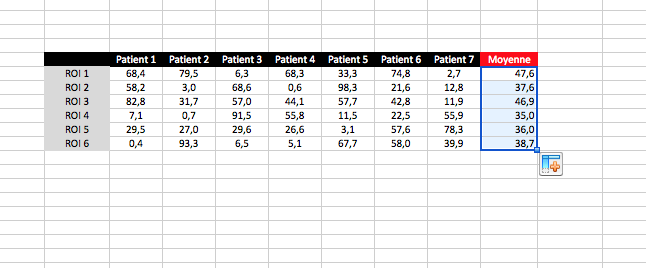
Excel permet de simplifier les calculs et de les modifier facilement. Nous allons commencer par du super simple avec de complexifier les choses. Dans ce tutoriel vous allez créer une feuille de calcul qui contient des données issues de l’analyse de vos patients. Imaginons que vous avez placé des ROI dans 6 zones chez 7 patients différents. Vous avez ensuite entré les valeurs de ces ROI dans un tableau comme suit.
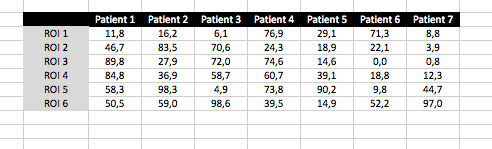
Moyenne
Nous allons extraire un maximum d’informations de ces données grâce aux formules proposées par Excel. Et vous allez voir que vous n’avez pas besoin d’un logiciel de statistiques plus complexe. Commençons par calculer la moyenne des valeurs obtenues par les ROI. Créer une nouvelle colonne que vous appelez moyenne.
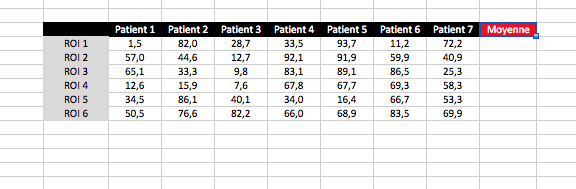
Vous cliquez ensuite dans la première case de la colonne. Vous tapez « =MOYENNE« . Les parenthèses s’ajoutent toutes seules.
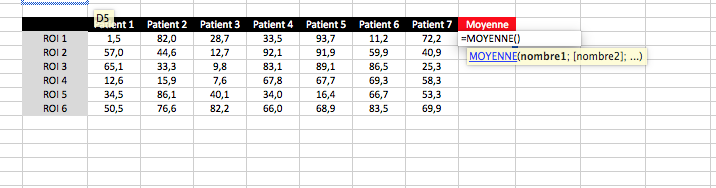
Ensuite vous sélectionnez toutes les cellules qui doivent être prise en compte pour le calcul de la moyenne. Et surtout vous appuyez sur ENTREE lorsque c’est fini.
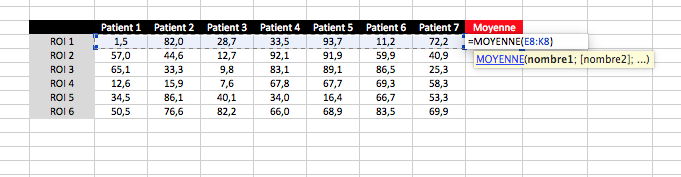
Ensuite vous cliquez dans le coin en bas à droite de la première case calculée et vous tirez vers le bas. Excel calcule toutes les autres moyennes des autres lignes. Rapide, efficace. Tout ce qu’on aime
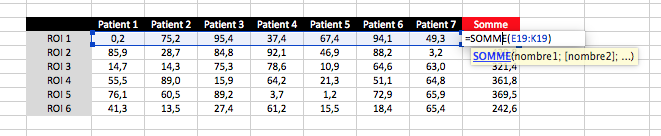
Somme
On peut décliner le principe avec la somme : « =SOMME() »
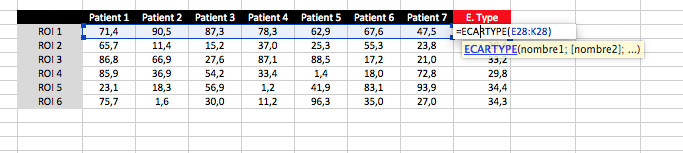
Ecart-type
Ou encore le calcul de l’écart-type aussi appelé déviation standard : « =ECARTYPE() »
Plus « compliqué » : t-test
Imaginons que l’on souhaite réaliser un test apparié pour comparer deux méthodes d’imagerie. On va réaliser un t-test. Pour cela il faut faire deux colonnes contenant les deux méthodes à comparer entre elles. Chaque ligne est une observation réalisée pour chaque méthode.
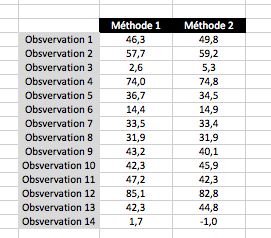
Comme pour les formules précédentes, on tape « =T.TEST« . Il faut indiquer 4 argumentsà Excel. Le premier la méthode 1, le deuxième la méthode 2, 1 pour unilatéral et 2 pour bilatéral puis 1 car les observations sont pairées.
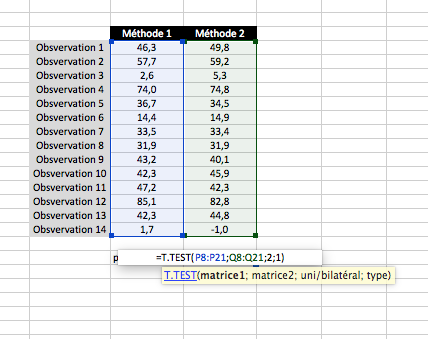
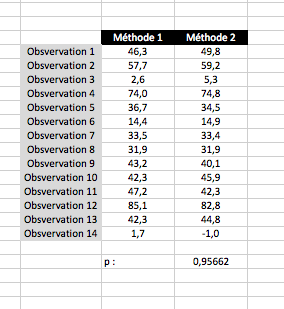
Dans cet exemple, la différence n’est pas significative.
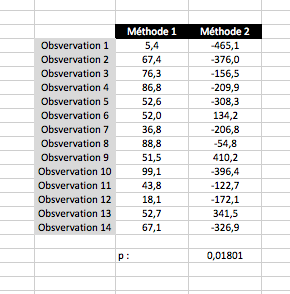
Dans cet exemple, la différence est significative.
Conclusion
C’est relativement simple de faire ses statistiques sur Excel car le logiciel contient la plupart des fonctions de base pour l’écriture d’un papier. Par ailleurs on le trouve plus facilement que des logiciels plus complexes. Enfin, des milliers de tutoriaux sont disponibles sur internet donc un coup de main est plus rapide à trouver.
Comme je suis très sympa, voici en téléchargement un fichier d’exemples.
Si vous avez des questions envoyez les en commentaire de l’article.

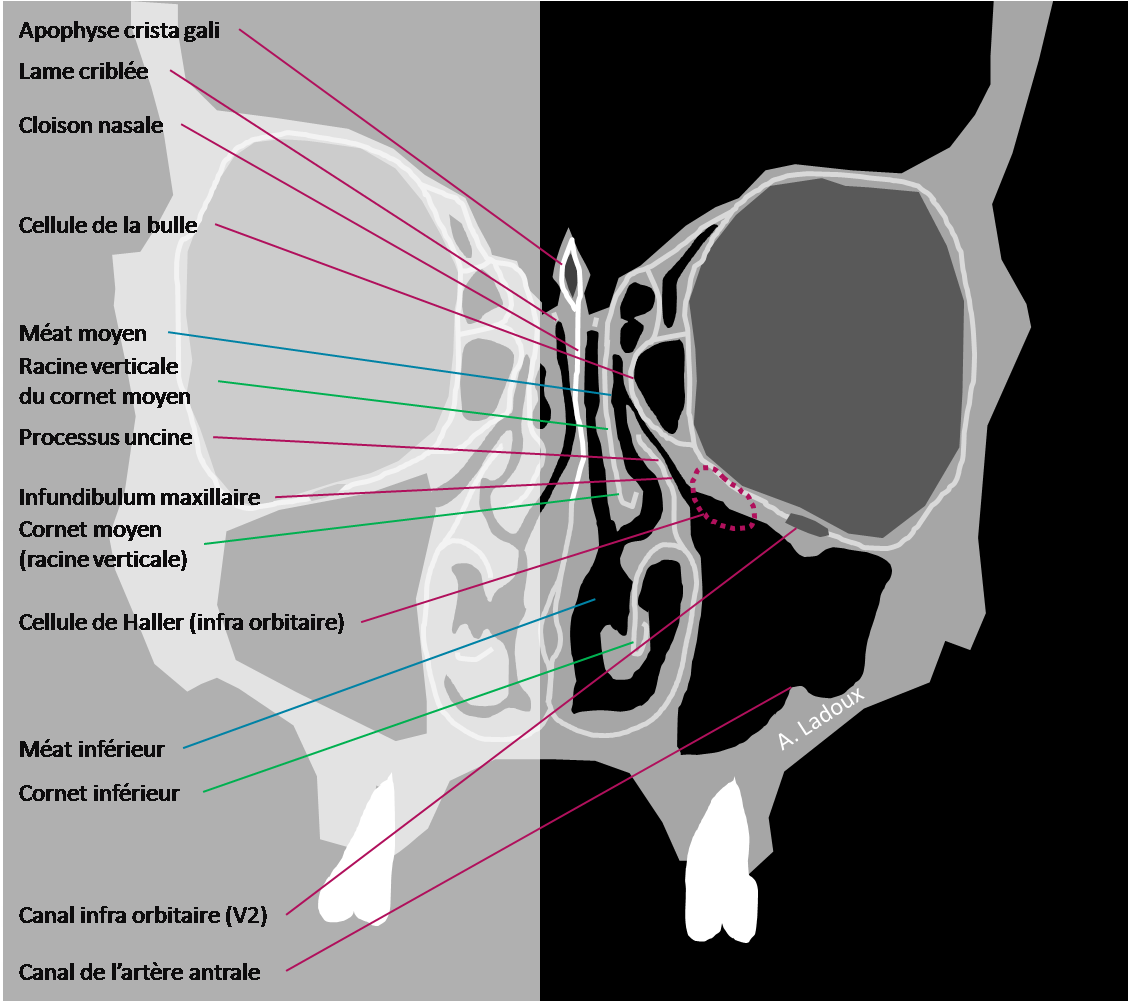
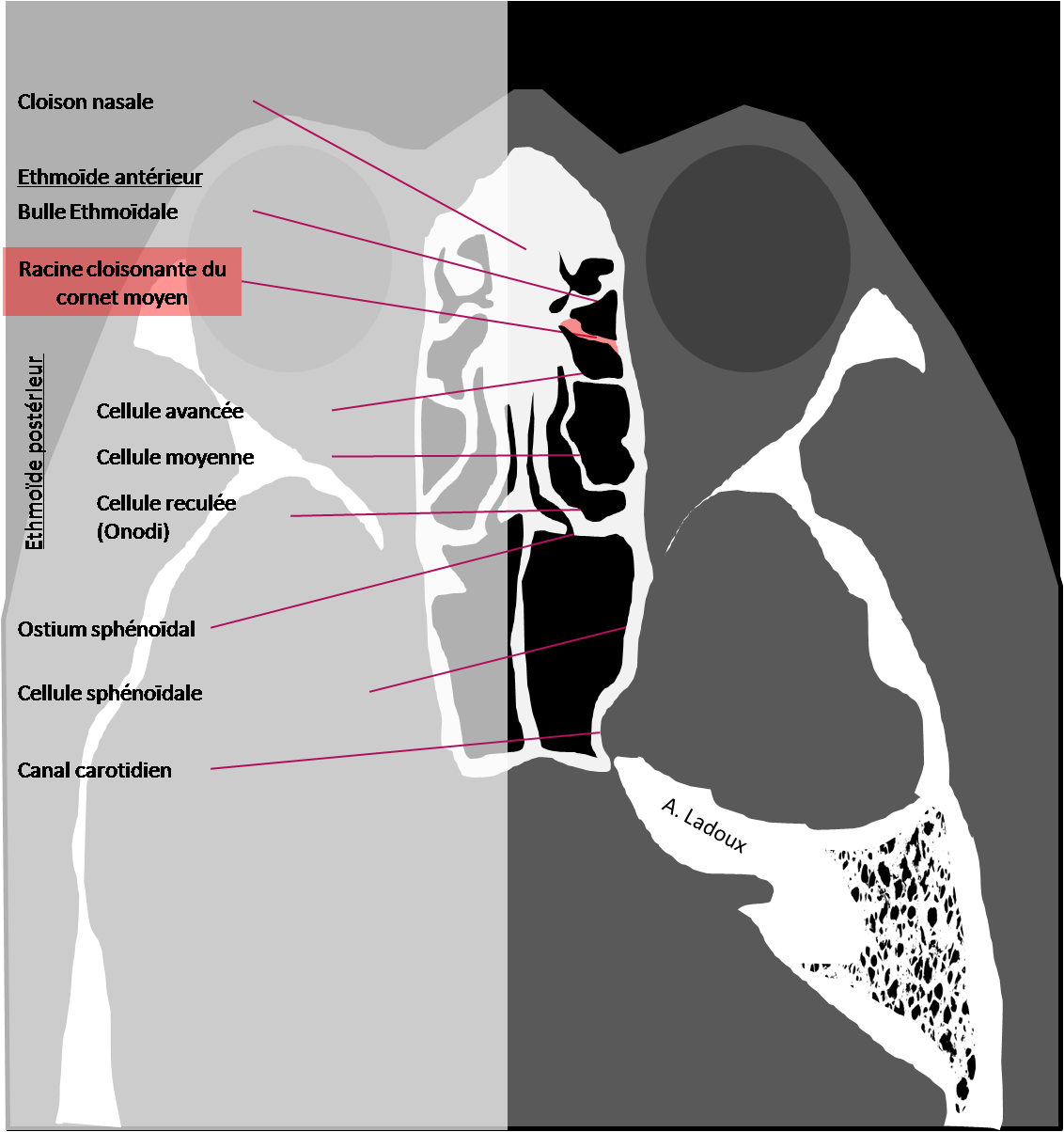
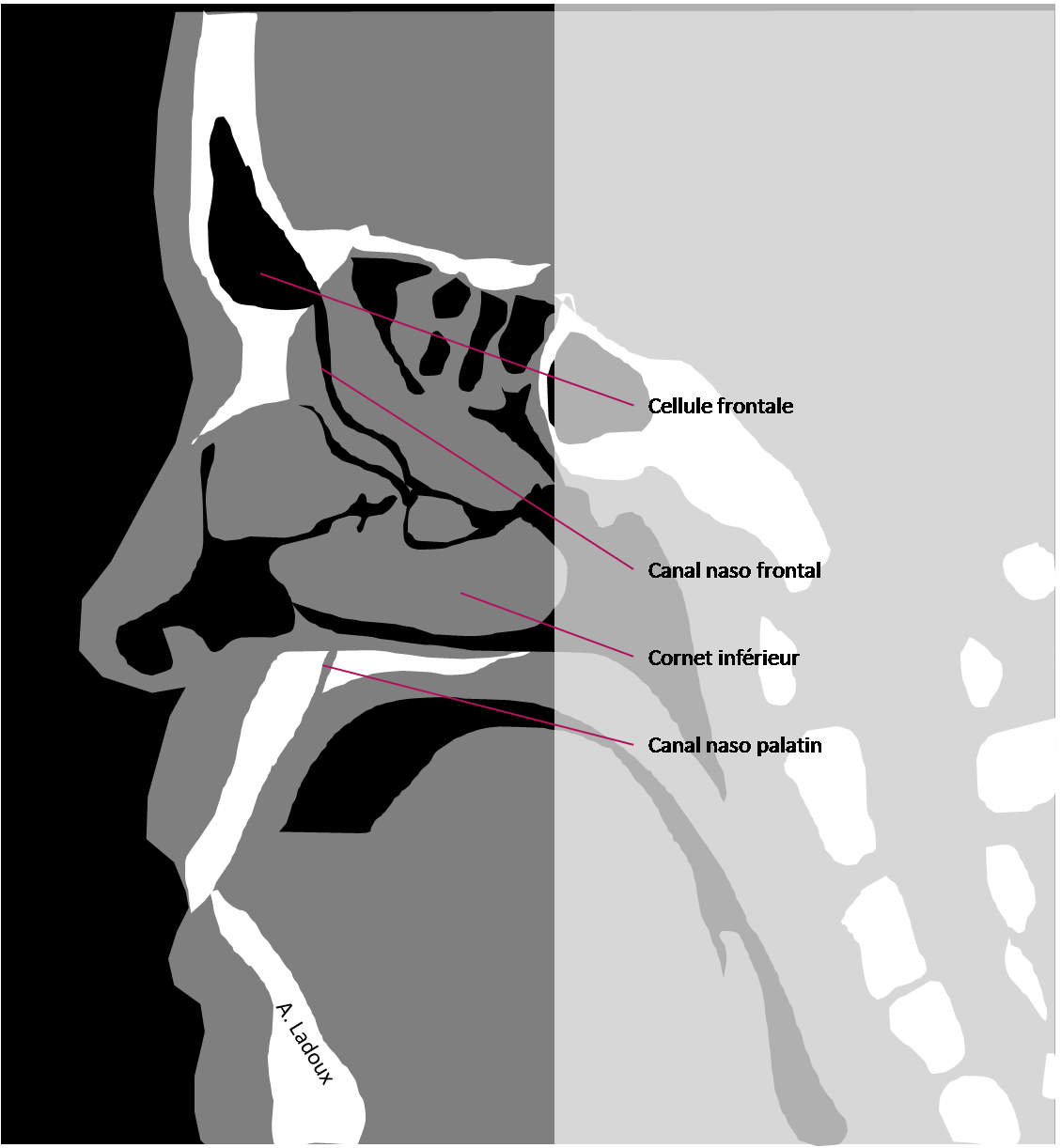
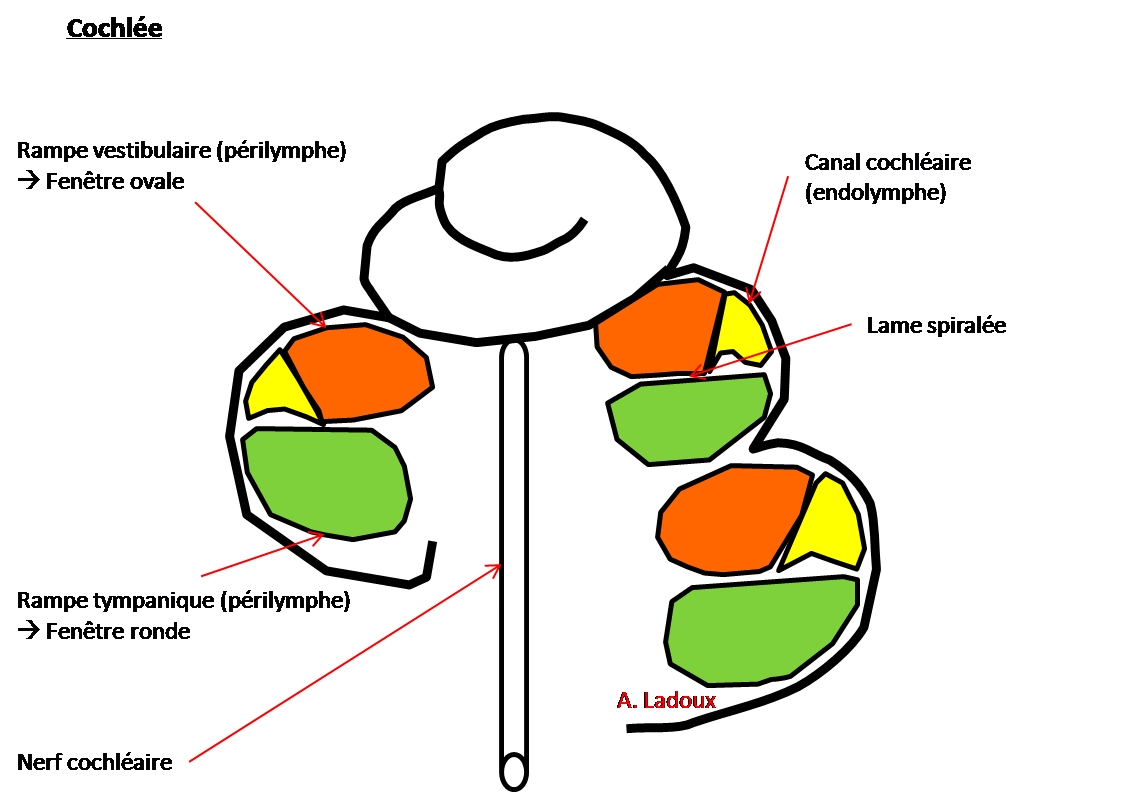

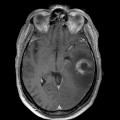
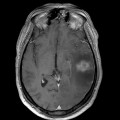
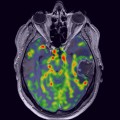
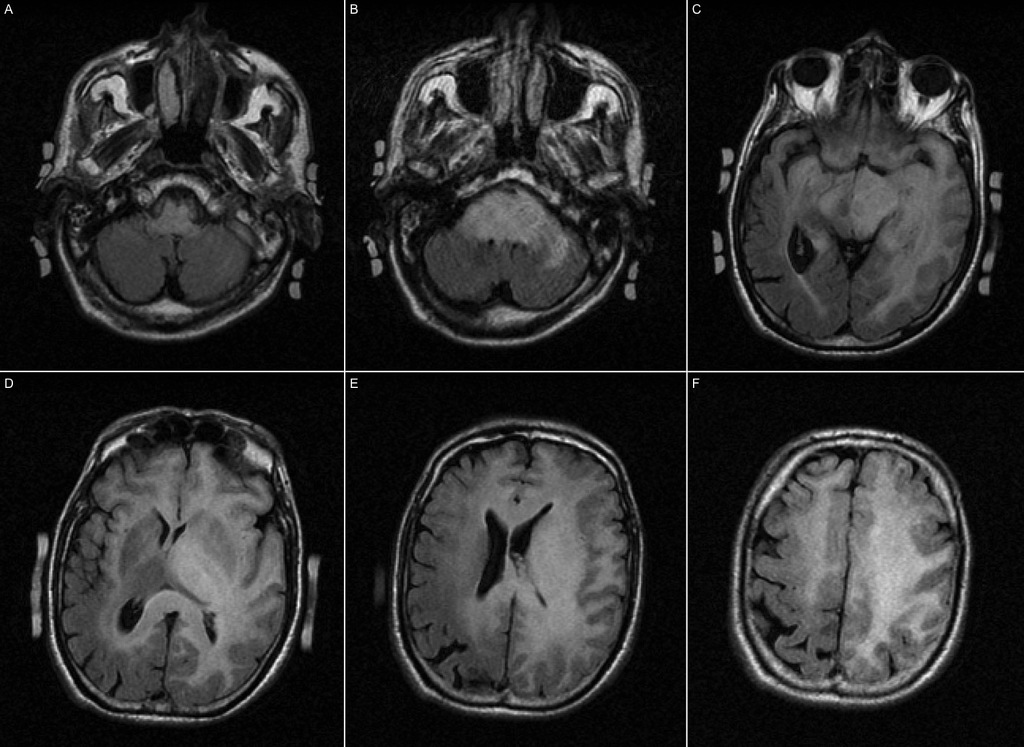
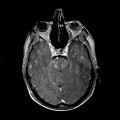
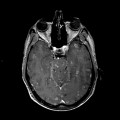
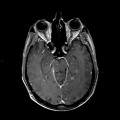
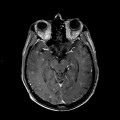


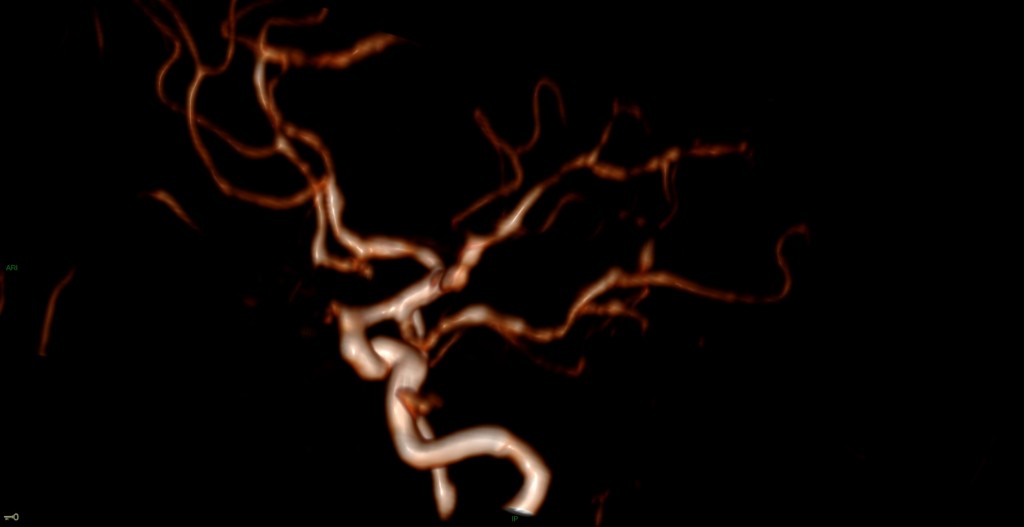
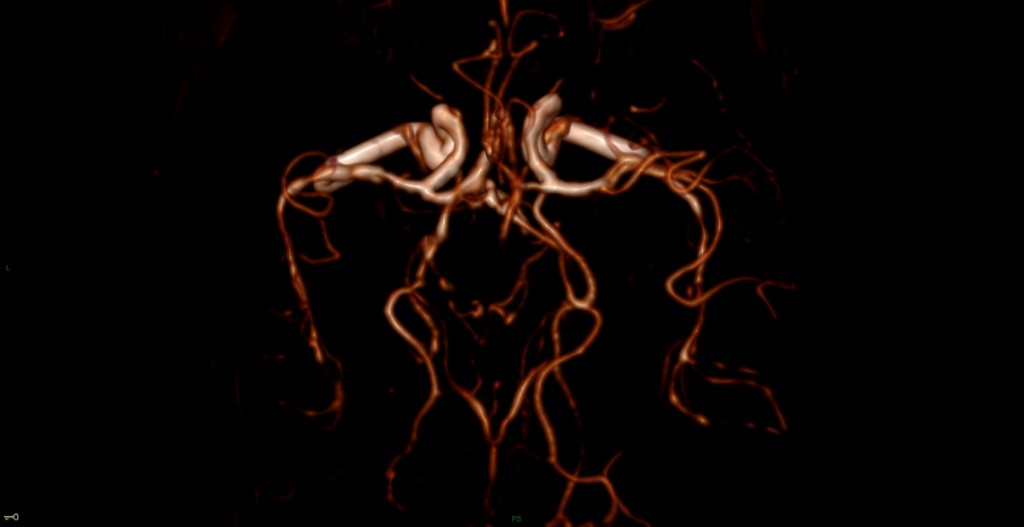
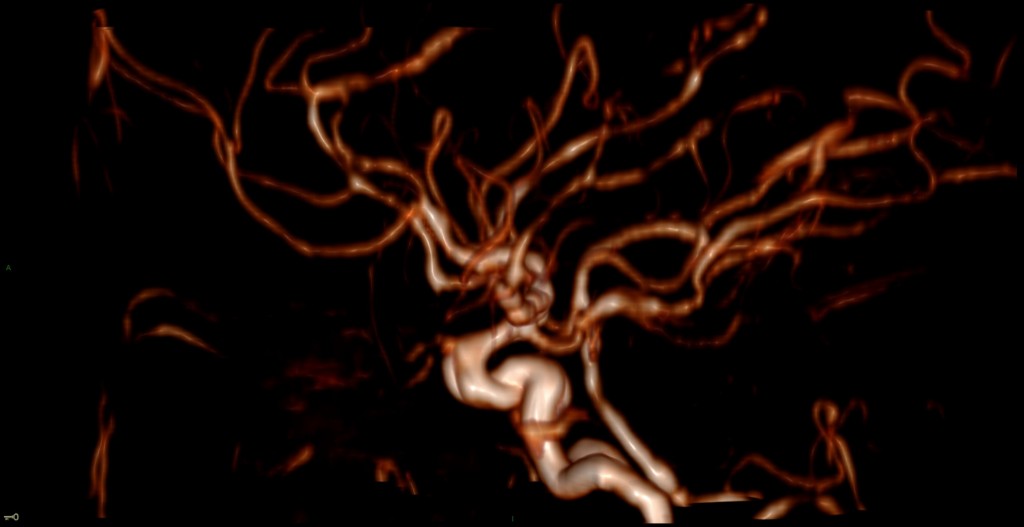
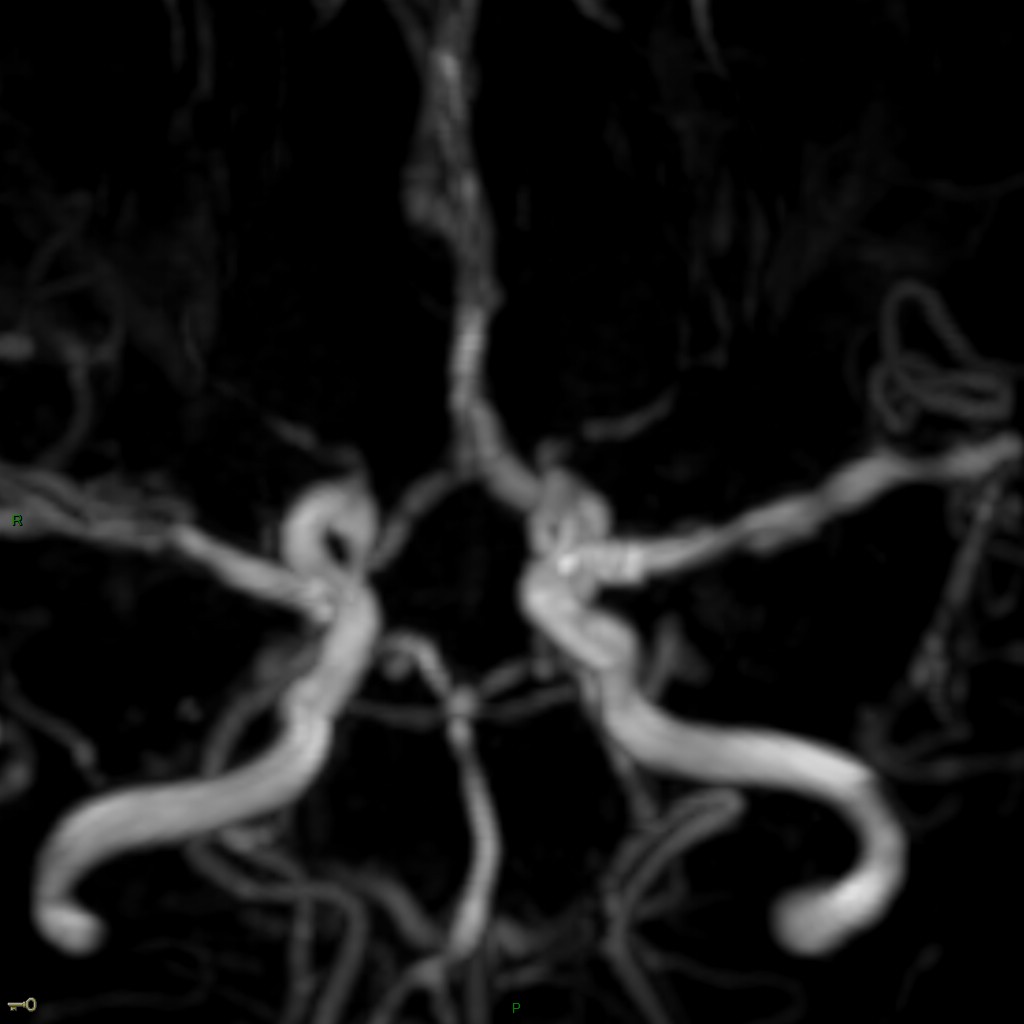




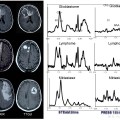
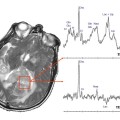
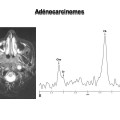
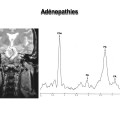

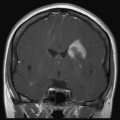
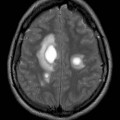
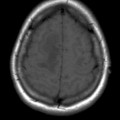
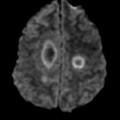
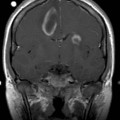
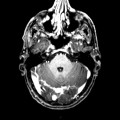
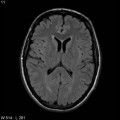
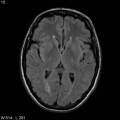
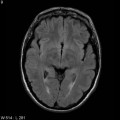
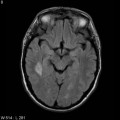
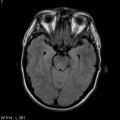
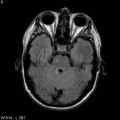
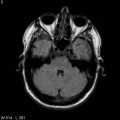
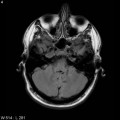

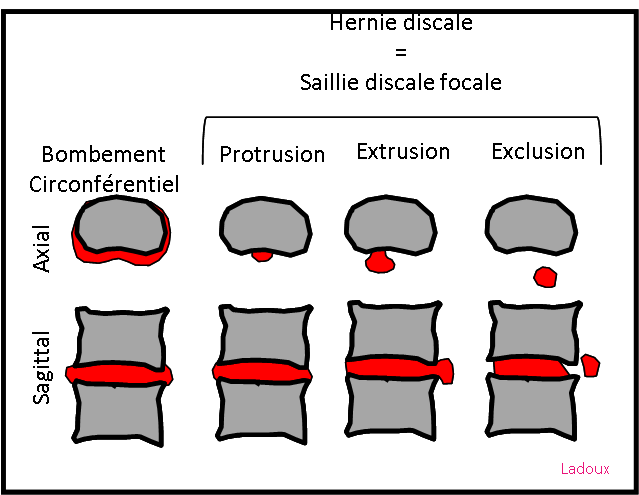
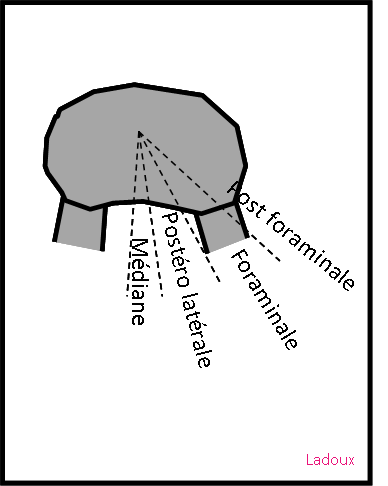
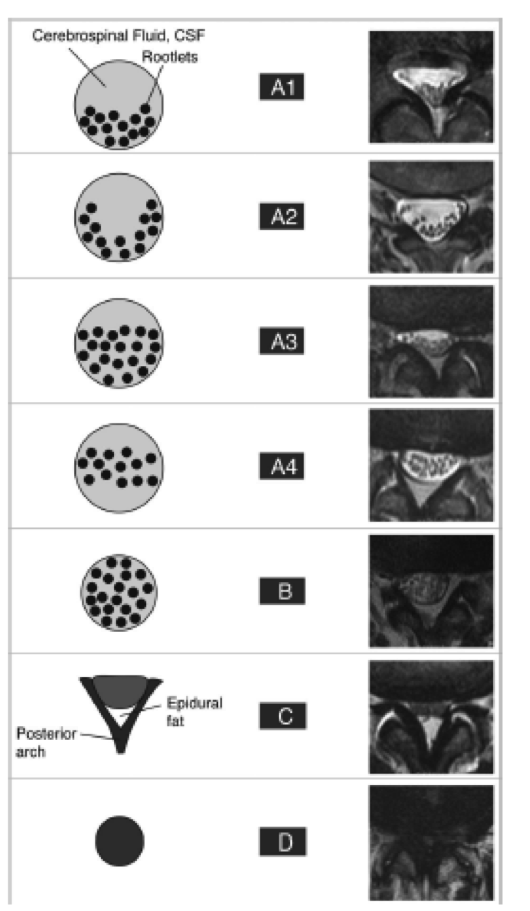
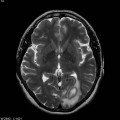
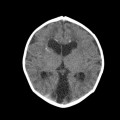
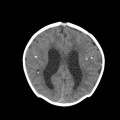
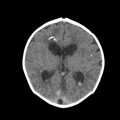
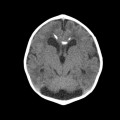
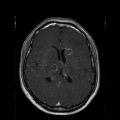
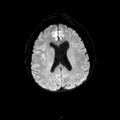
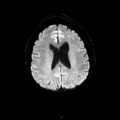
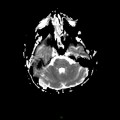
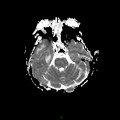
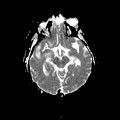
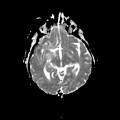
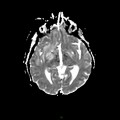
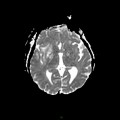
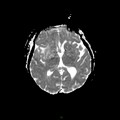
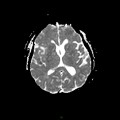
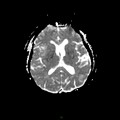
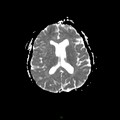
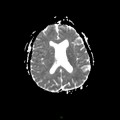
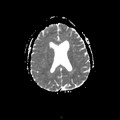
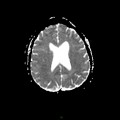
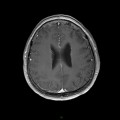
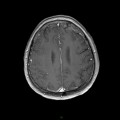
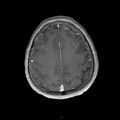
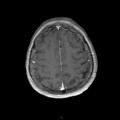
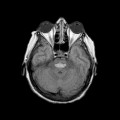
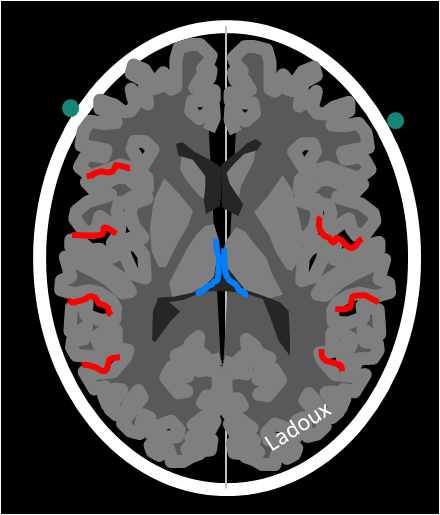 Mort encéphalique
Mort encéphalique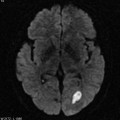
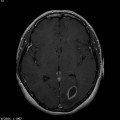

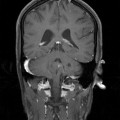
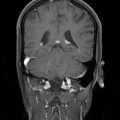
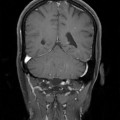
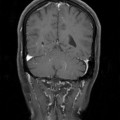
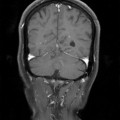
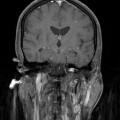
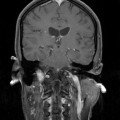
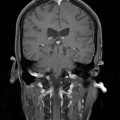
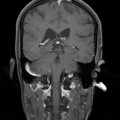
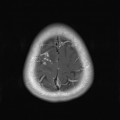
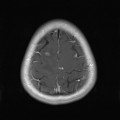
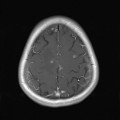
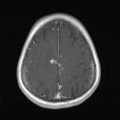
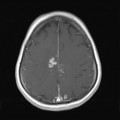
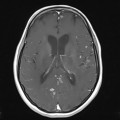
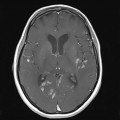
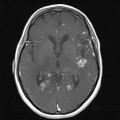
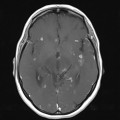
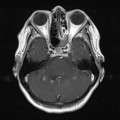
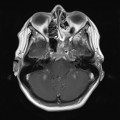
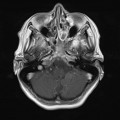
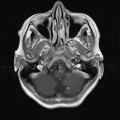
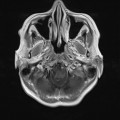
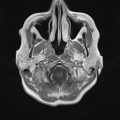
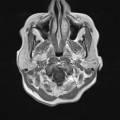
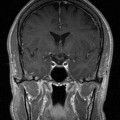
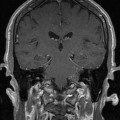
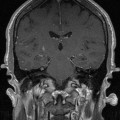
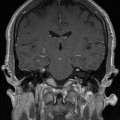
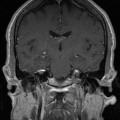
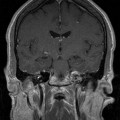
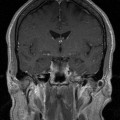
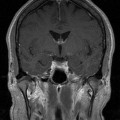
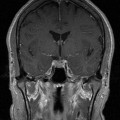
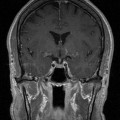
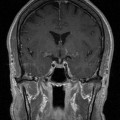
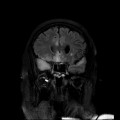
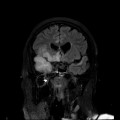
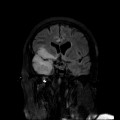
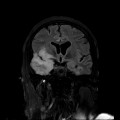
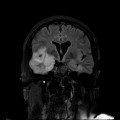
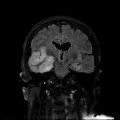
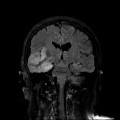
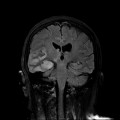
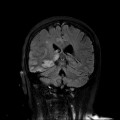
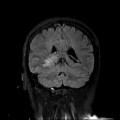
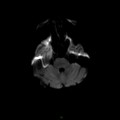
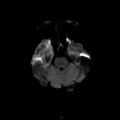
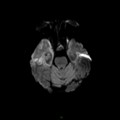
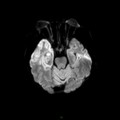
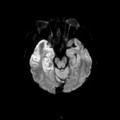
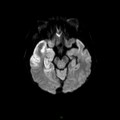
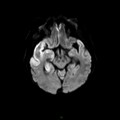
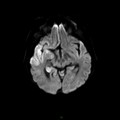
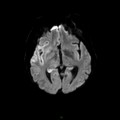
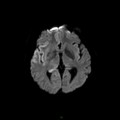
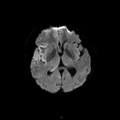
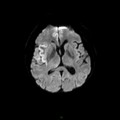
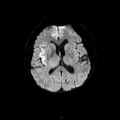
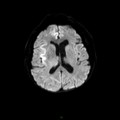
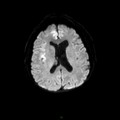
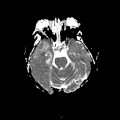
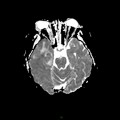
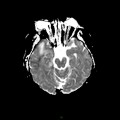
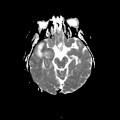
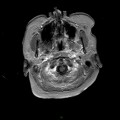
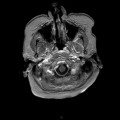
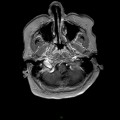
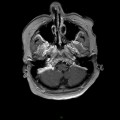
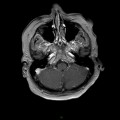
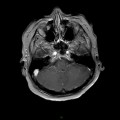
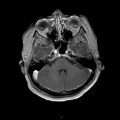
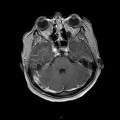
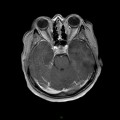
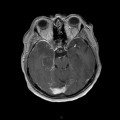
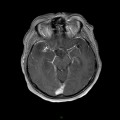
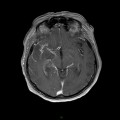
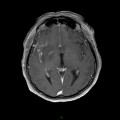
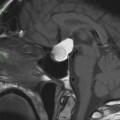
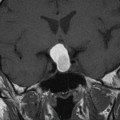
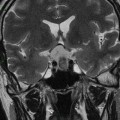
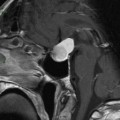
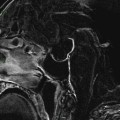
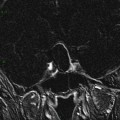
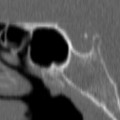
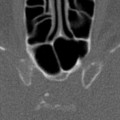
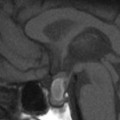
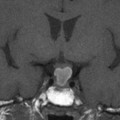
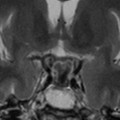
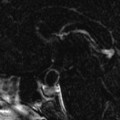
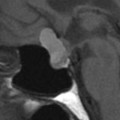
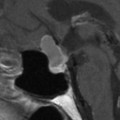
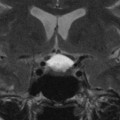
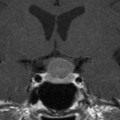
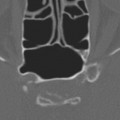
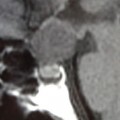
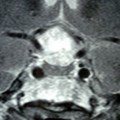
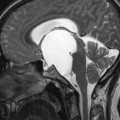
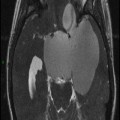
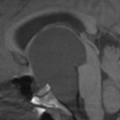
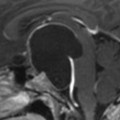
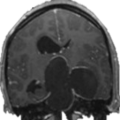
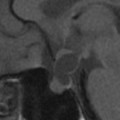
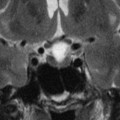
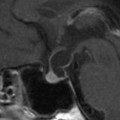
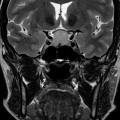
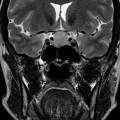
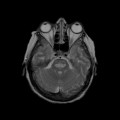
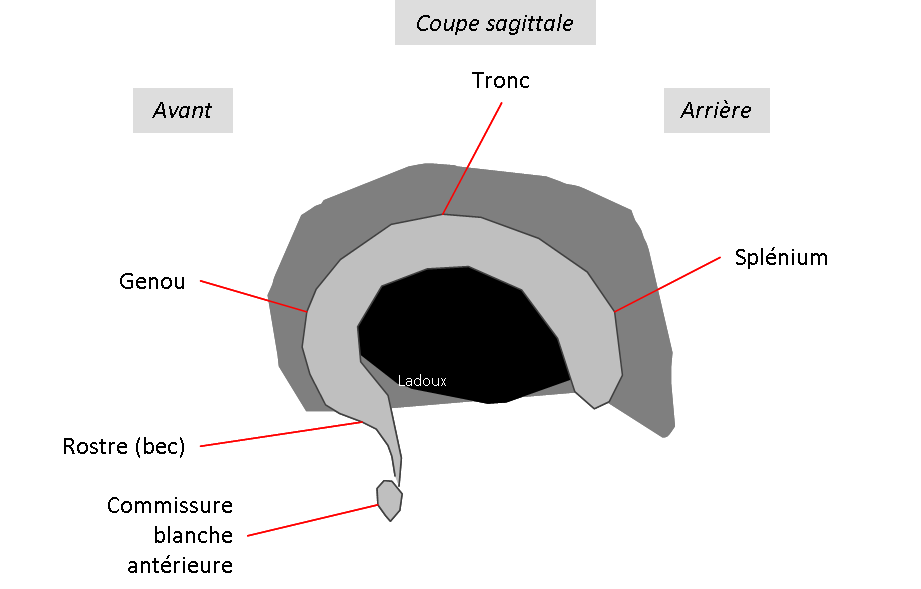
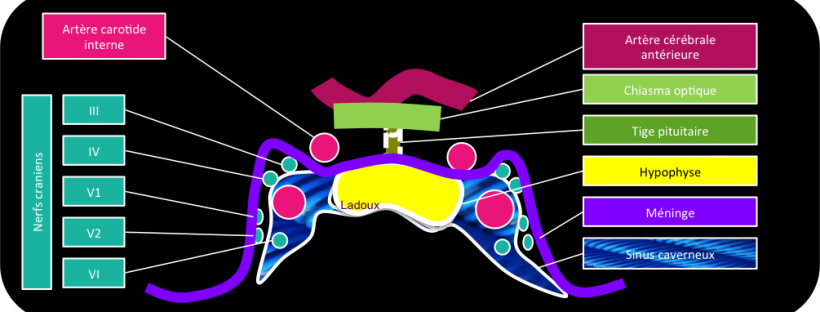 Coupe coronale centrée sur la selle turcique
Coupe coronale centrée sur la selle turcique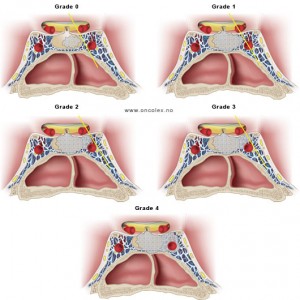
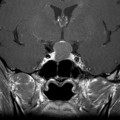
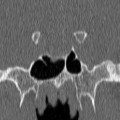
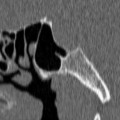
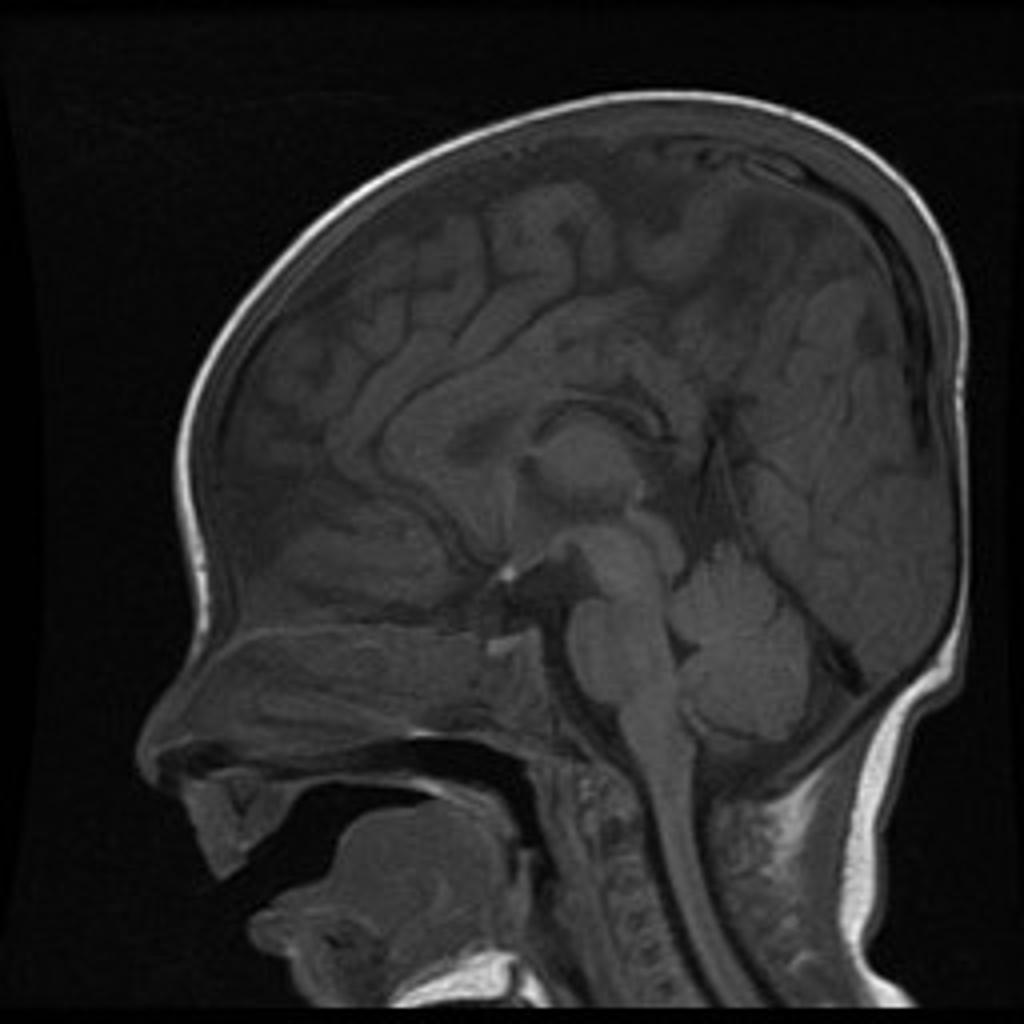
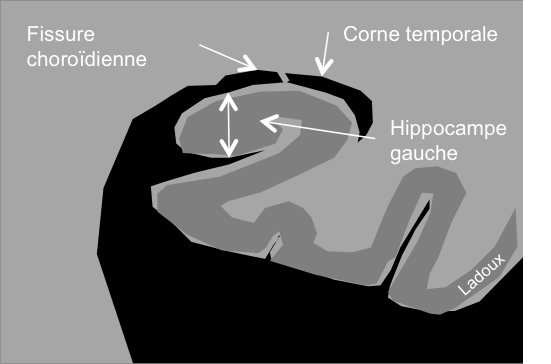
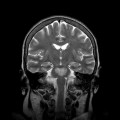
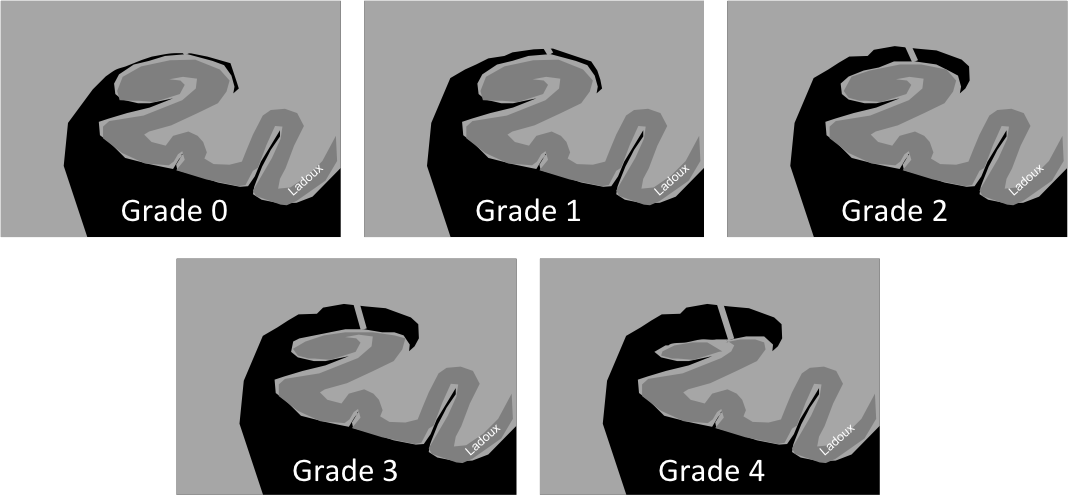 Echelle de Scheltens (atrophie hippocampique)
Echelle de Scheltens (atrophie hippocampique)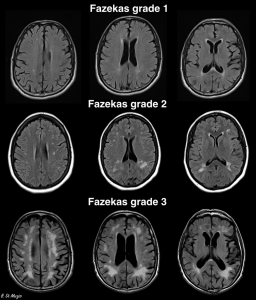
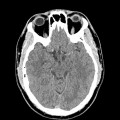
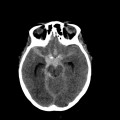
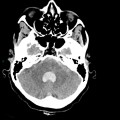
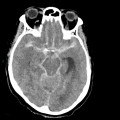
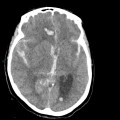
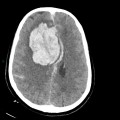
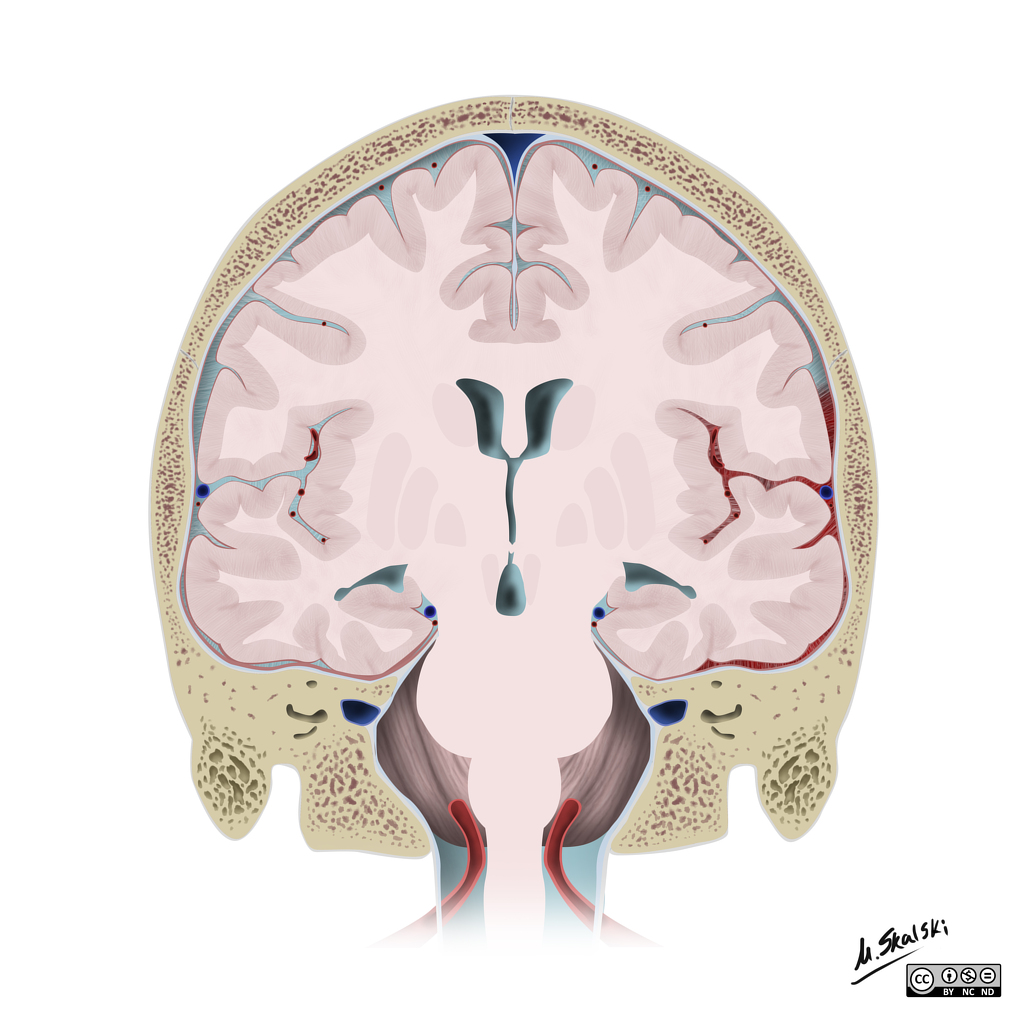
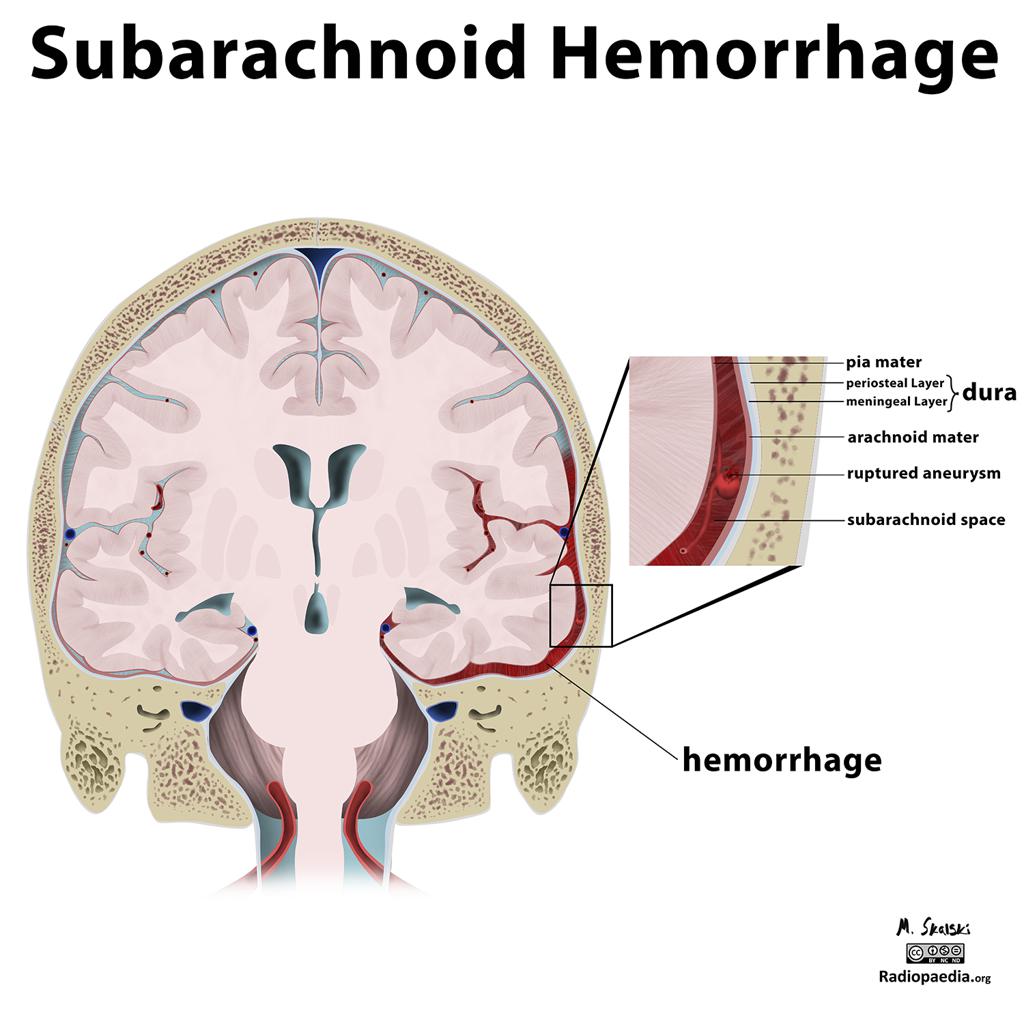
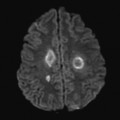
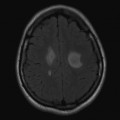
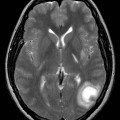
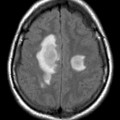
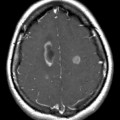
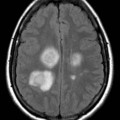
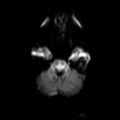
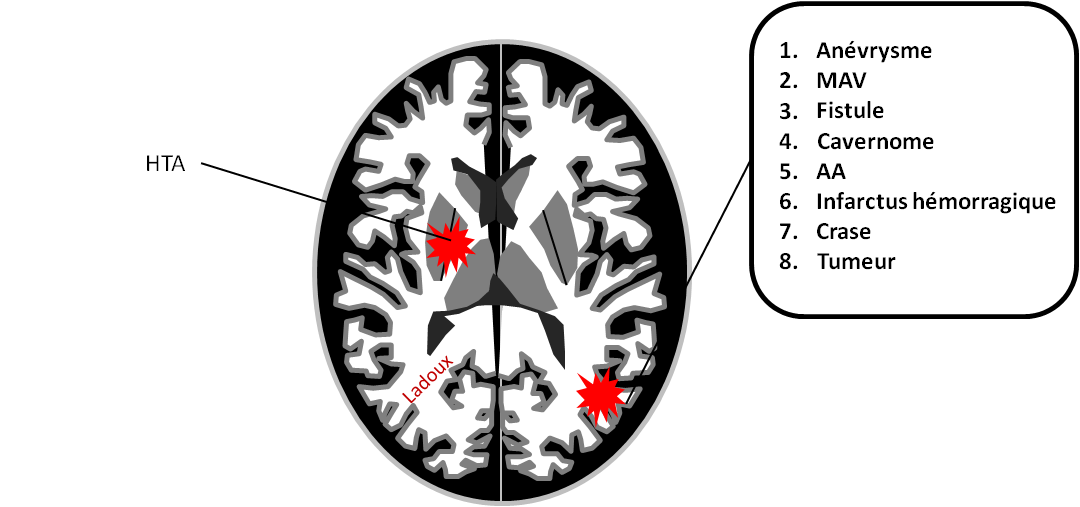 Hématomes cérébraux intra parenchymateux
Hématomes cérébraux intra parenchymateux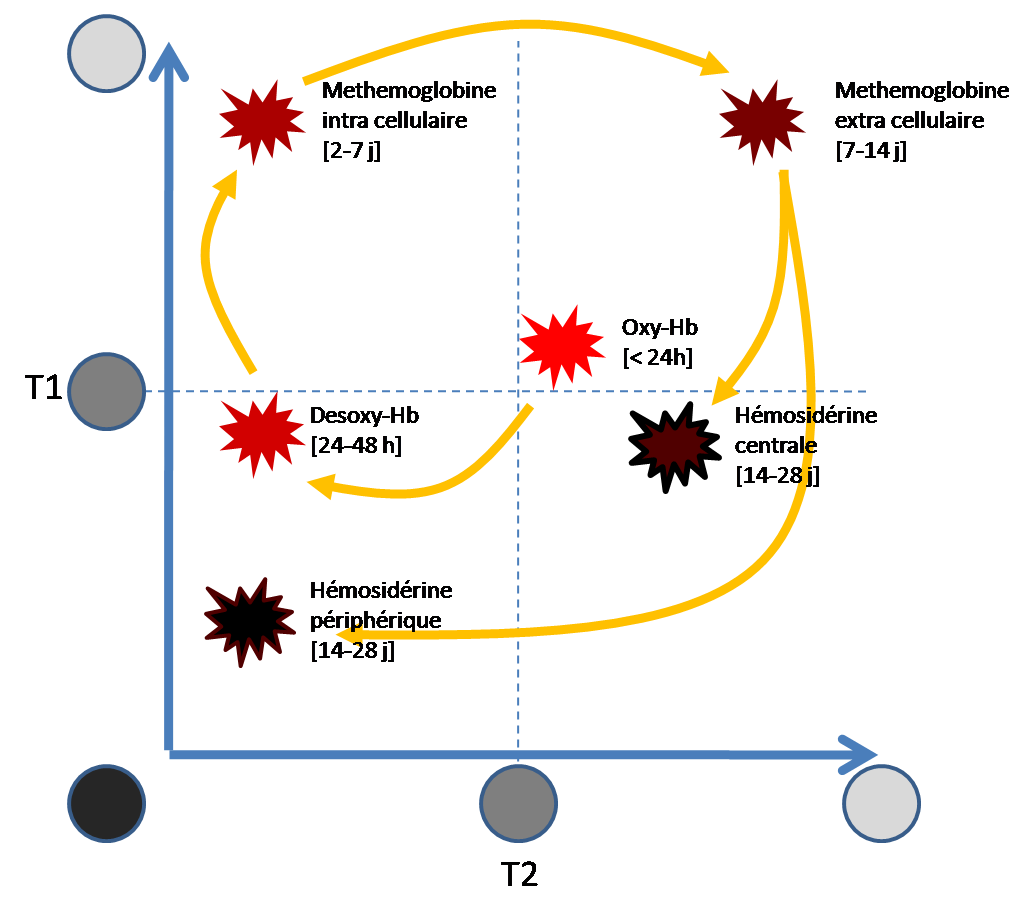
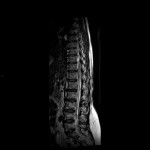
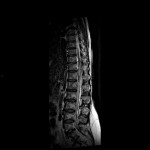
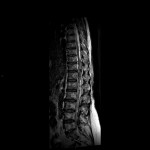
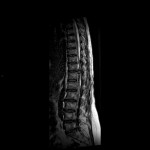
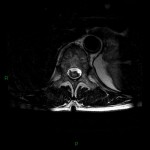
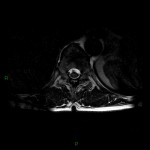
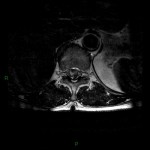
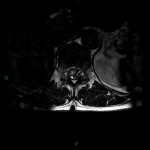




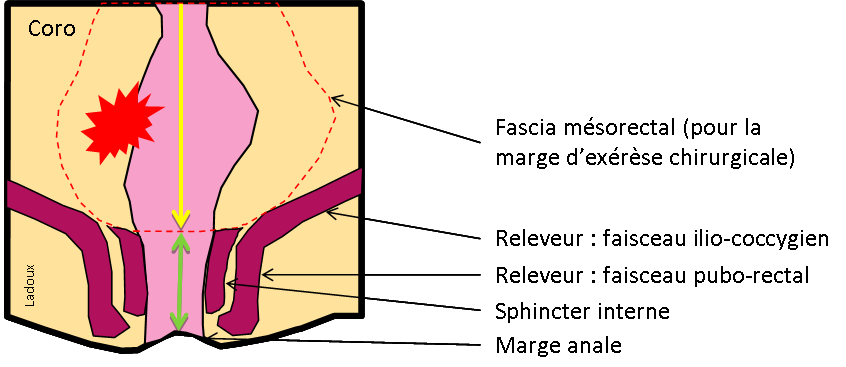
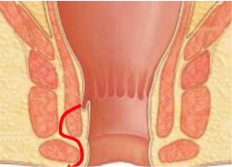
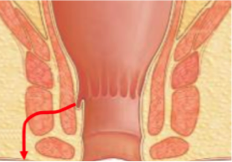
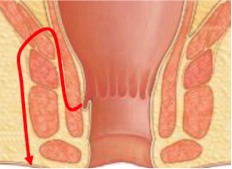

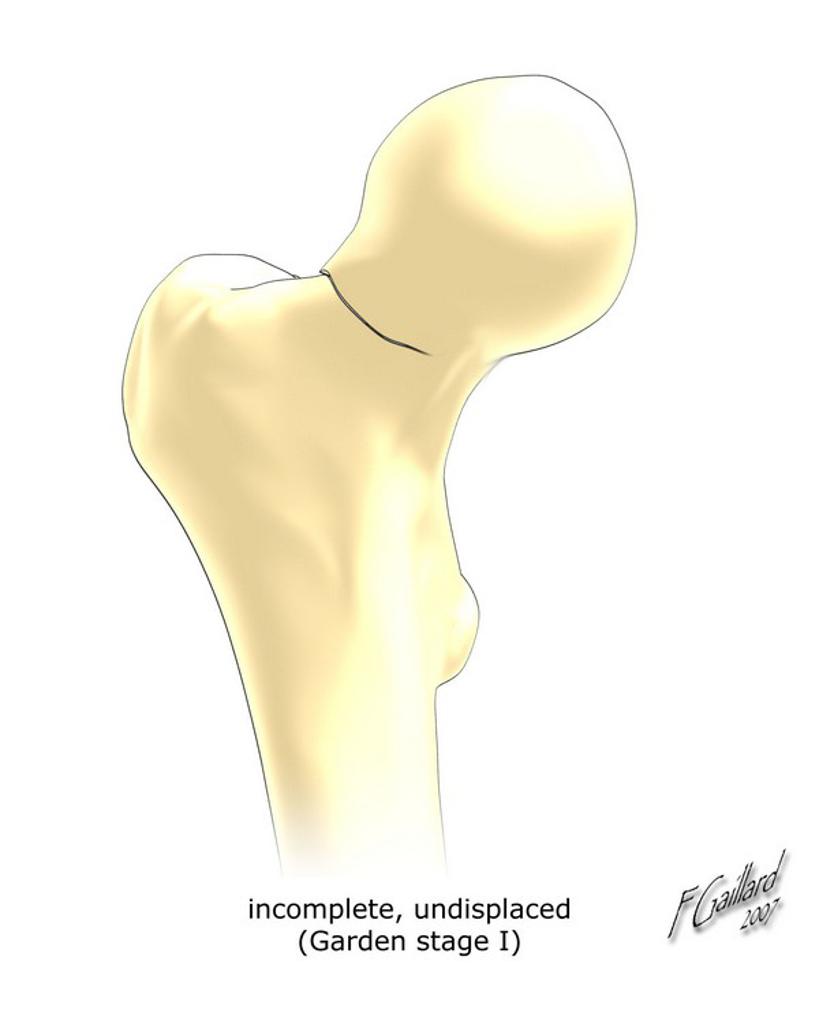
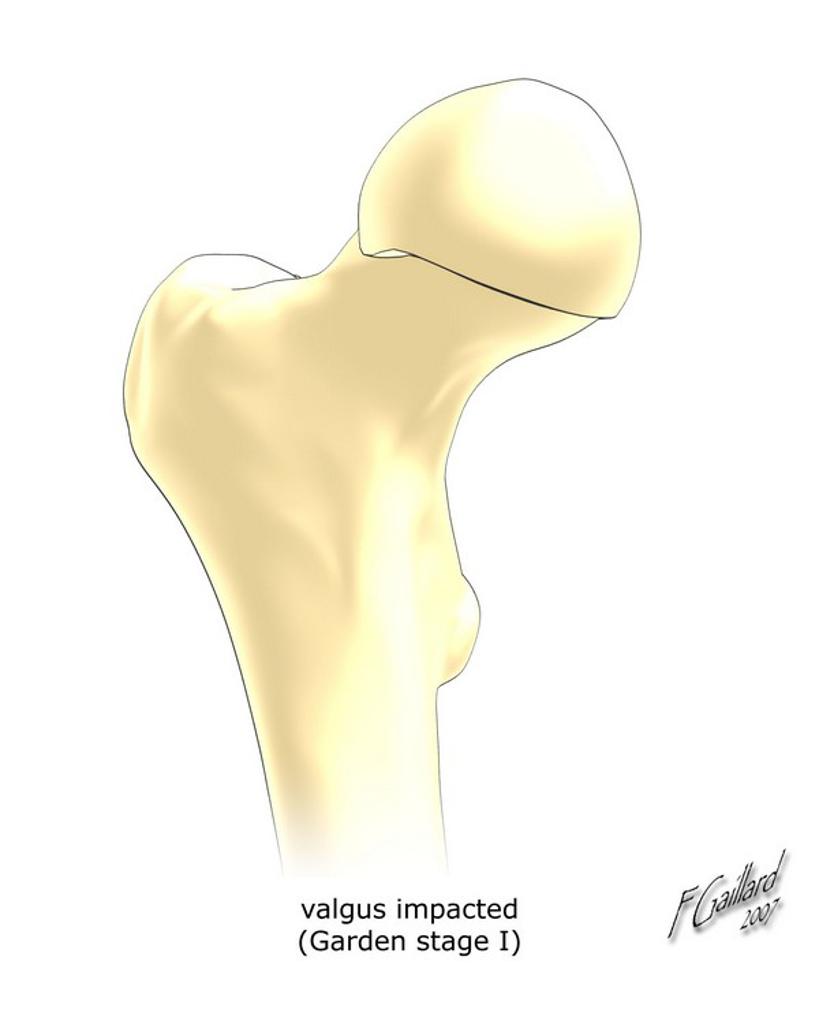
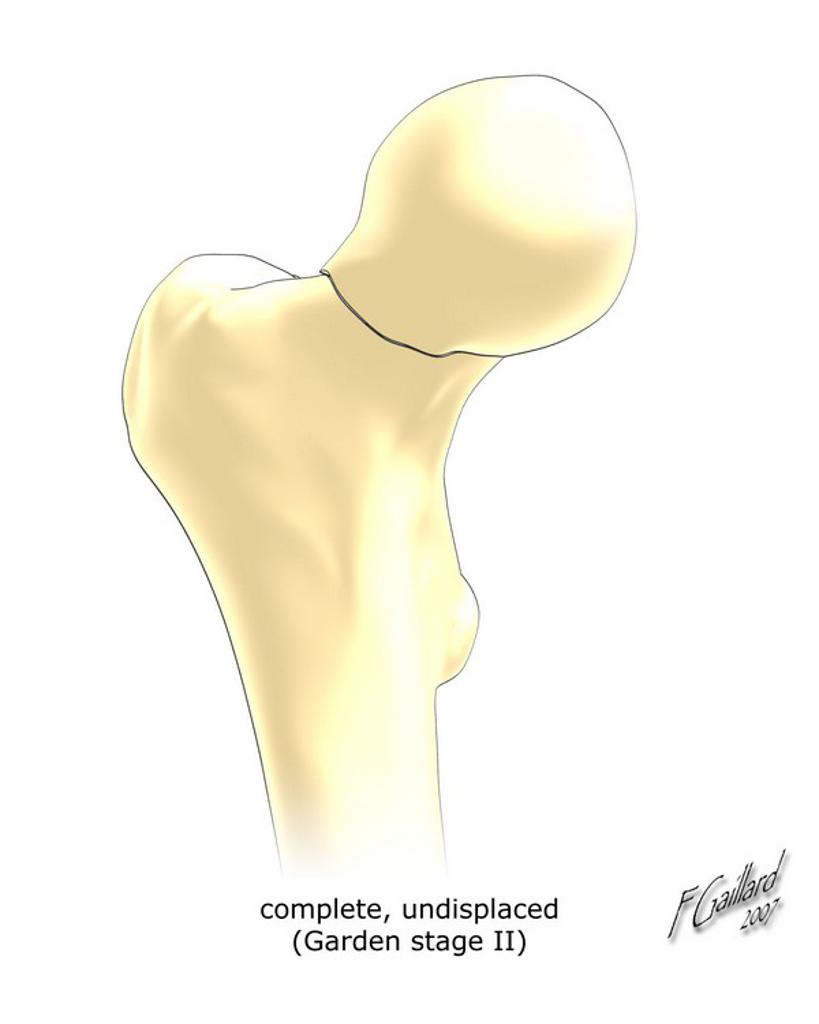
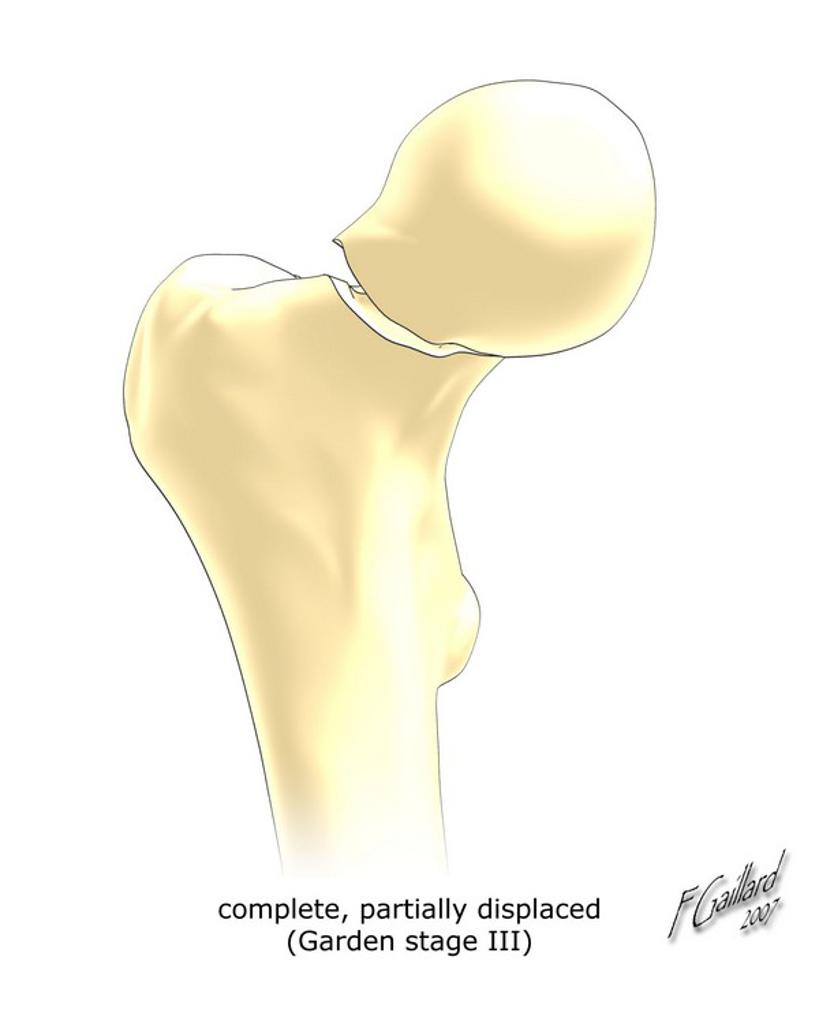
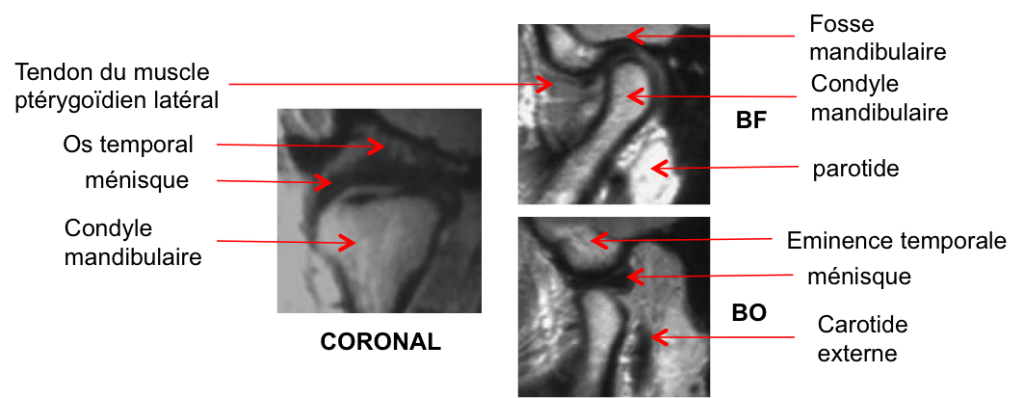
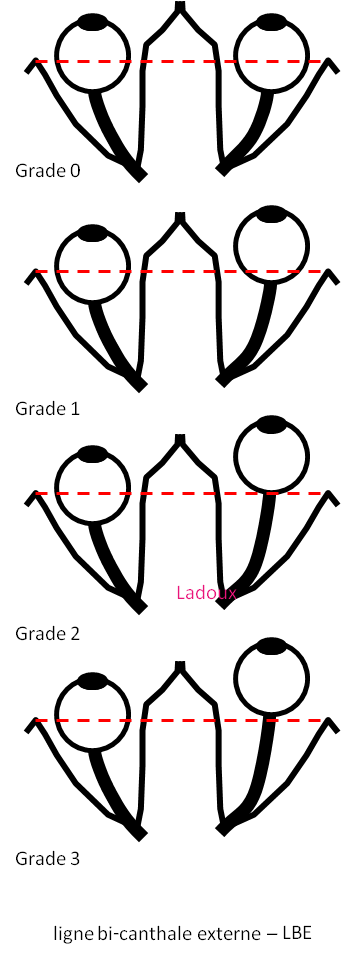
 Grade 1 [DCM débutante réductible] : perte de contact condyle et bourrelet antérieur,
Grade 1 [DCM débutante réductible] : perte de contact condyle et bourrelet antérieur,