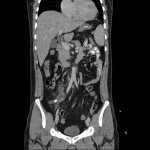
SCANNER CEREBRAL ET THORACO-ABDOMINO-PELVIEN
INDICATION
Etat clinique de mort encéphalique.
Bilan diagnostic
Recherche de lésion avant possible prélèvement d’organe
TECHNIQUE
Acquisition hélicoïdale sur l’encéphale sans injection de produit de contraste.
Acquisition hélicoïdale sur l’abdomen sans injection de produit de contraste.
Injection de produit de contraste iodé sur cathéter veineux périphérique.
A 20 secondes, acquisition hélicoïdale sur l’encéphale.
A 35 secondes, acquisition hélicoïdale sur le thorax et l’abdomen
A 60 secondes, acquisition hélicoïdale sur l’encéphale.
A 90 secondes, acquisition hélicoïdale sur l’abdomen et le pelvis.
DLP : mGy.cm
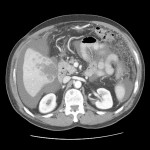
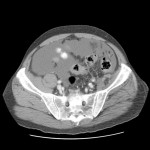
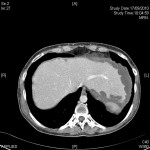
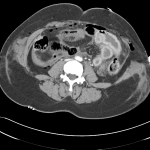
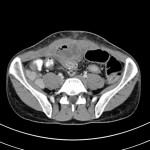
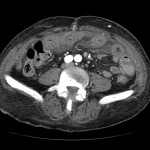
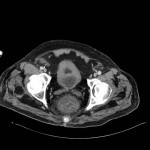
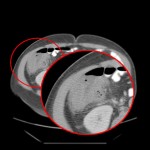
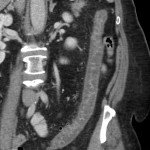
RESULTATS
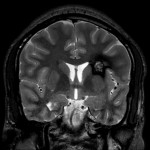
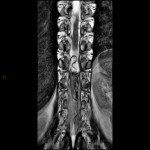
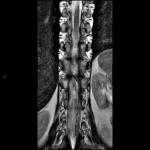
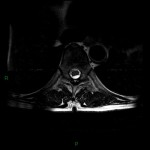
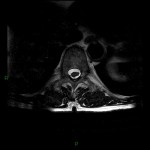
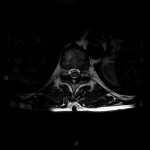
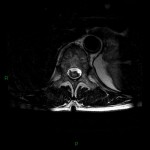
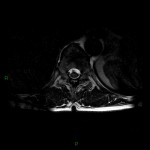
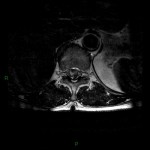
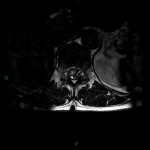
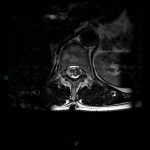
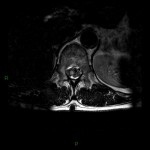
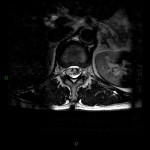
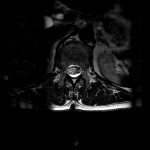
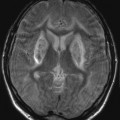
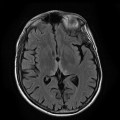
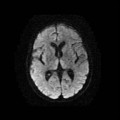
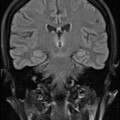
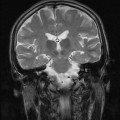
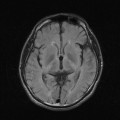
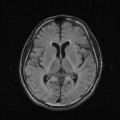
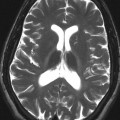
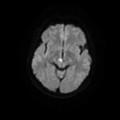
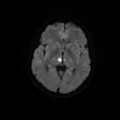
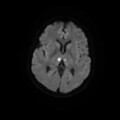
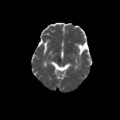
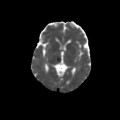
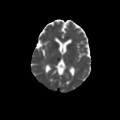
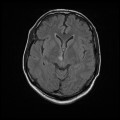
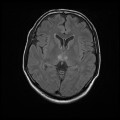
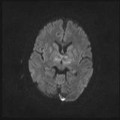
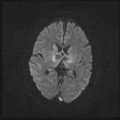
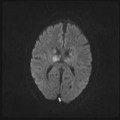
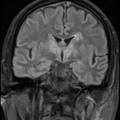
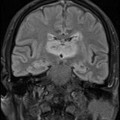
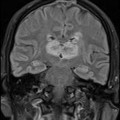
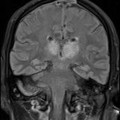
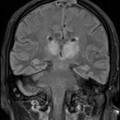
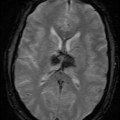
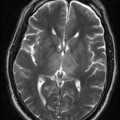
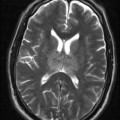
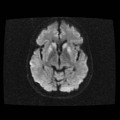
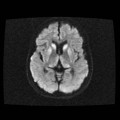
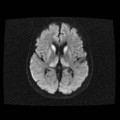
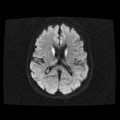
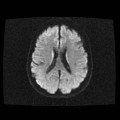
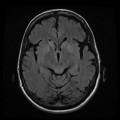
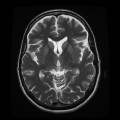
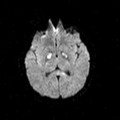
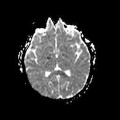
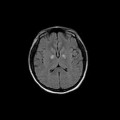
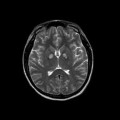
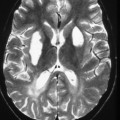
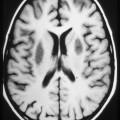
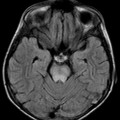
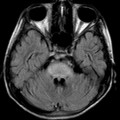
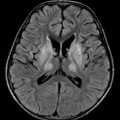
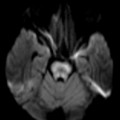
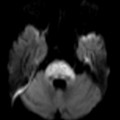
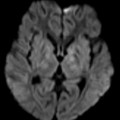
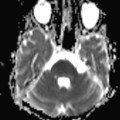
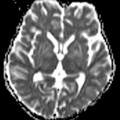
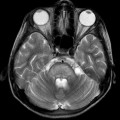
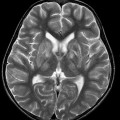
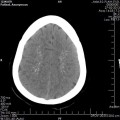
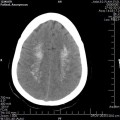
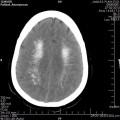
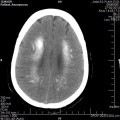
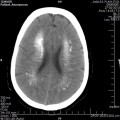
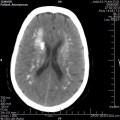
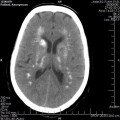
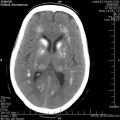
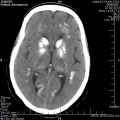
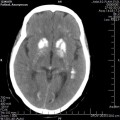
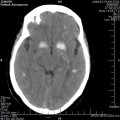
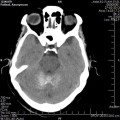
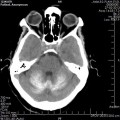
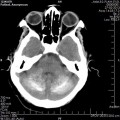
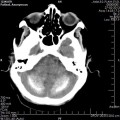
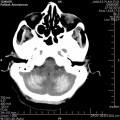
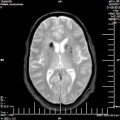
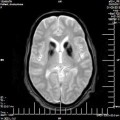
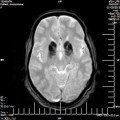
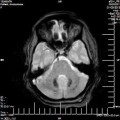
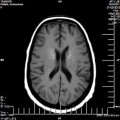
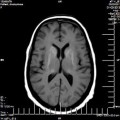
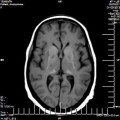
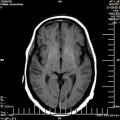
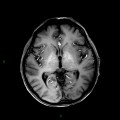
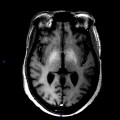
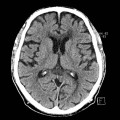
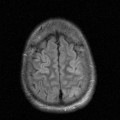
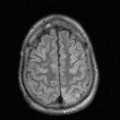
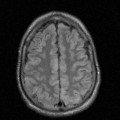
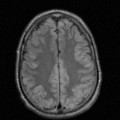
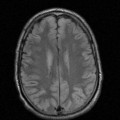
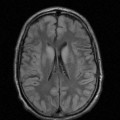
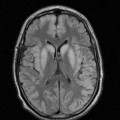
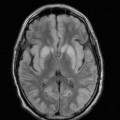
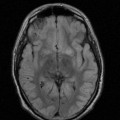
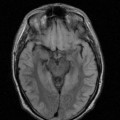
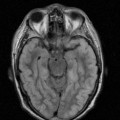
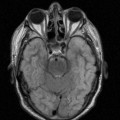
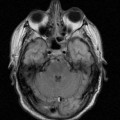
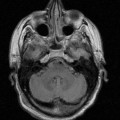
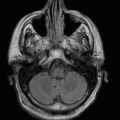
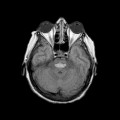
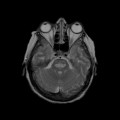
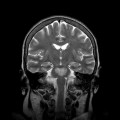
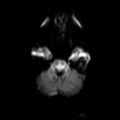
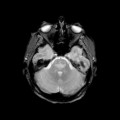
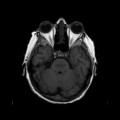
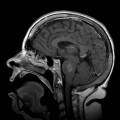
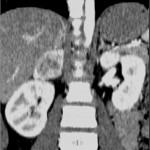
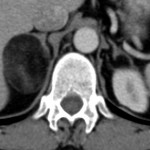
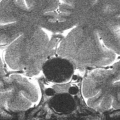
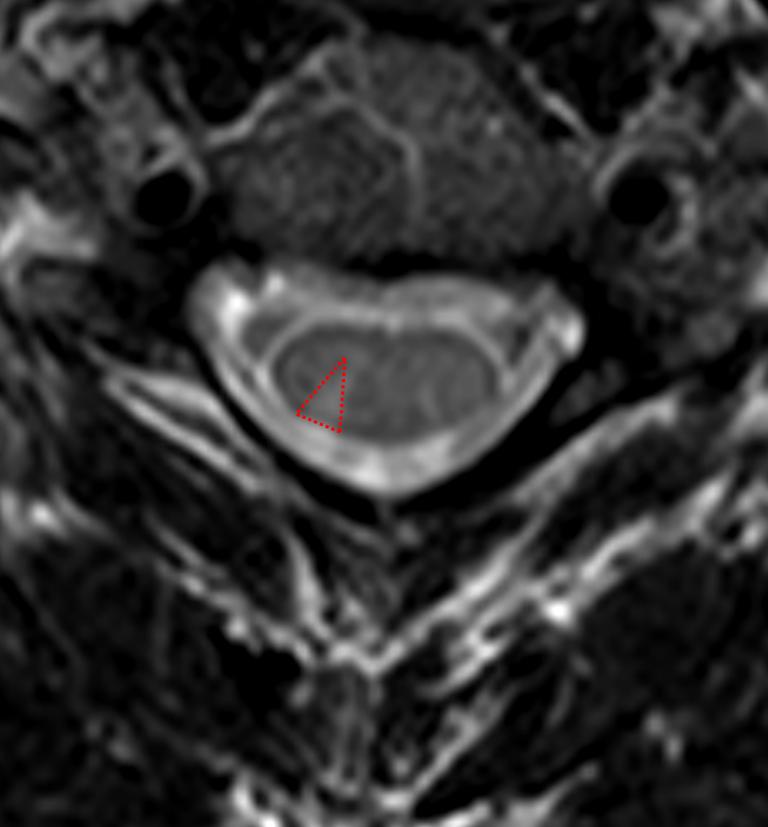
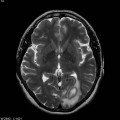
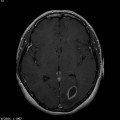
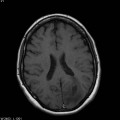
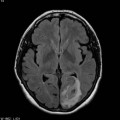
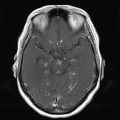
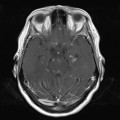
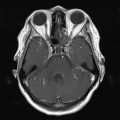
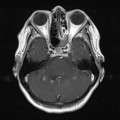
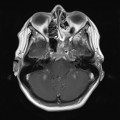
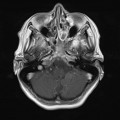
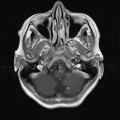
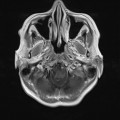
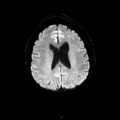
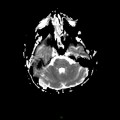
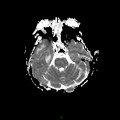
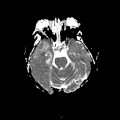
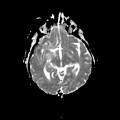
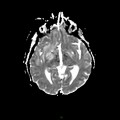
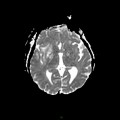
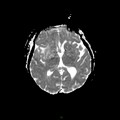
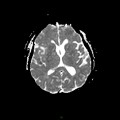
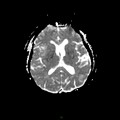
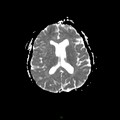
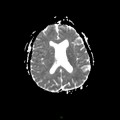
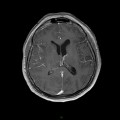
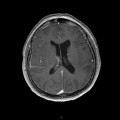
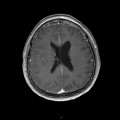
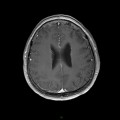
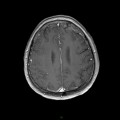
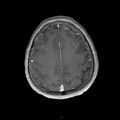
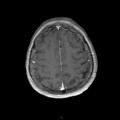
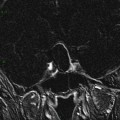
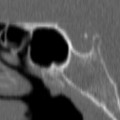
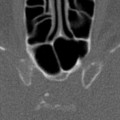
A l’étage encéphalique :
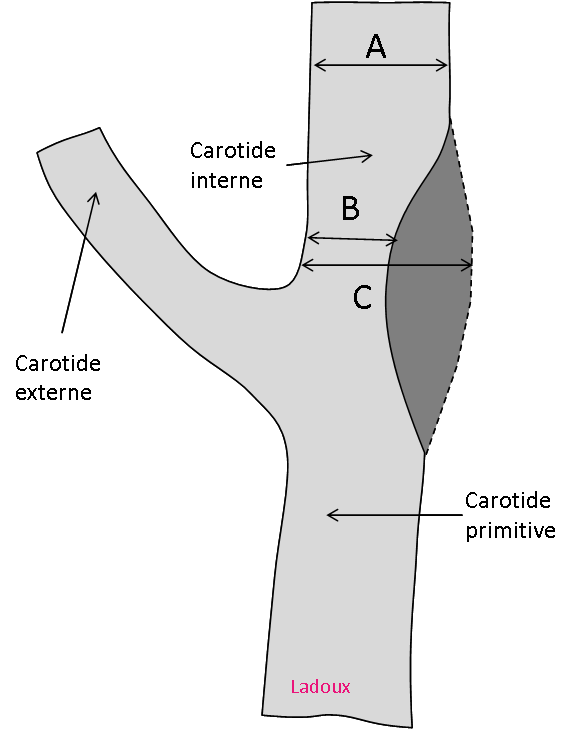
Opacification satisfaisante des artères temporales superfcielles
Rehaussement des branches M3-M4 de l’artère sylvienne droite.
Rehaussement des branches M3-M4 de l’artère sylvienne gauche.
Rehaussement des veines cérébrales internes.
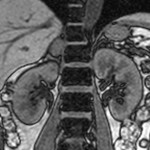
Absence de rehaussement des branches M3-M4 de l’artère sylvienne droite.
Absence de rehaussement des branches M3-M4 de l’artère sylvienne gauche.
Absence de rehaussement des veines cérébrales internes.
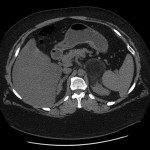
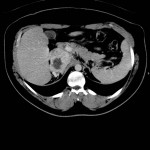
A l’étage thoracique :
En filtre médiastinal,
Pas d’adénopathie axillaire ou médiastinale.
Pas d’épanchement pleuro-péricardique.
Pas d’anomalie de la paroi thoracique.
Pas d’anomalie des gros vaisseaux ou des cavités cardiaques.
Pas de lésion ostéolytique ou ostéocondensante suspecte visualisée.
En filtre pulmonaire,
Pas de foyer parenchymateux organisé si nodule suspect visualisé.
Pas d’anomalie du calibre des bronches.
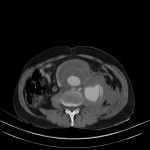
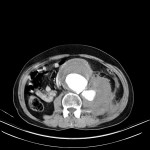
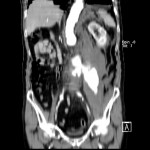
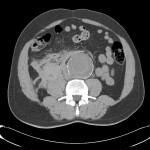
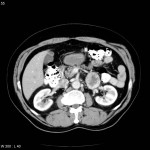
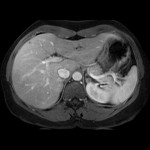
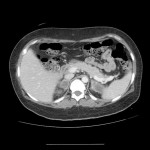
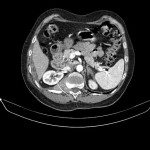
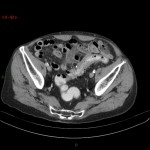
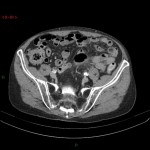
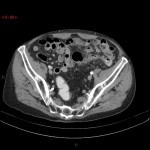
A l’étage abdomino-pelvien :
Pas de lésion focale visualisée sur le foie, des deux reins, le pancréas, la rate et les deux urrénales.
Pas d’épanchement péritonéal liquidien ou gazeux.
Pas d’adénopathie coelio-mésentérique, para lombo-aortique ou iliaque décelée.
Pas de densification de la graisse péritonéale.
Les orifices herniaires sont libres.
Pas de distension des anses digestives.
Pas de lésion ostéolytique ou ostéo-condensante suspecte.
CONCLUSION
Absence d’arrêt circulatoire cérébral
Arrêt circulatoire cérébral
Absence de lésion d’allure tumorale décelée
Iconographie mise à disposition sous forme de planche papier et conservée localement sur le PACS./em>
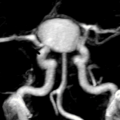
ANGIOSCANNER CEREBRAL POUR CONFIRMATION DE L’ETAT de MORT ENCEPHALIQUE
INDICATION
Diagnostic clinique de mort encéphalique validé : [oui/non]
Date et heure : [<>]
TECHNIQUE
Acquisition sans injection.
Acquisition 1 min après injection de [<>] mL de [<>].
RÉSULTATS
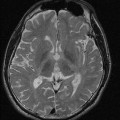
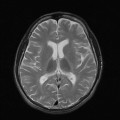
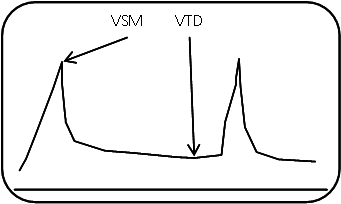
Visualisation des artères temporales superficielles droite et gauche : [oui/non]
Score de non opacification (1 = non opacification ; 0 = opacification) :
* modifié selon les recommandations des sociétés françaises de neuroradiologie et de radiologie (octobre 2010)
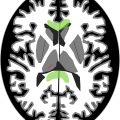
– Artères corticales de l’artère cérébrale moyenne droite : [ ]
– Artères corticales de l’artère cérébrale moyenne gauche : [ ]
– Veine cérébrale interne droite : [ ]
– Veine cérébrale interne gauche : [ ]
Total score de non opacification : [ ]
CONCLUSION
[<Score 0-3 : absence d’arrêt circulatoire>]
[<Score 4 : arrêt circulatoire >]
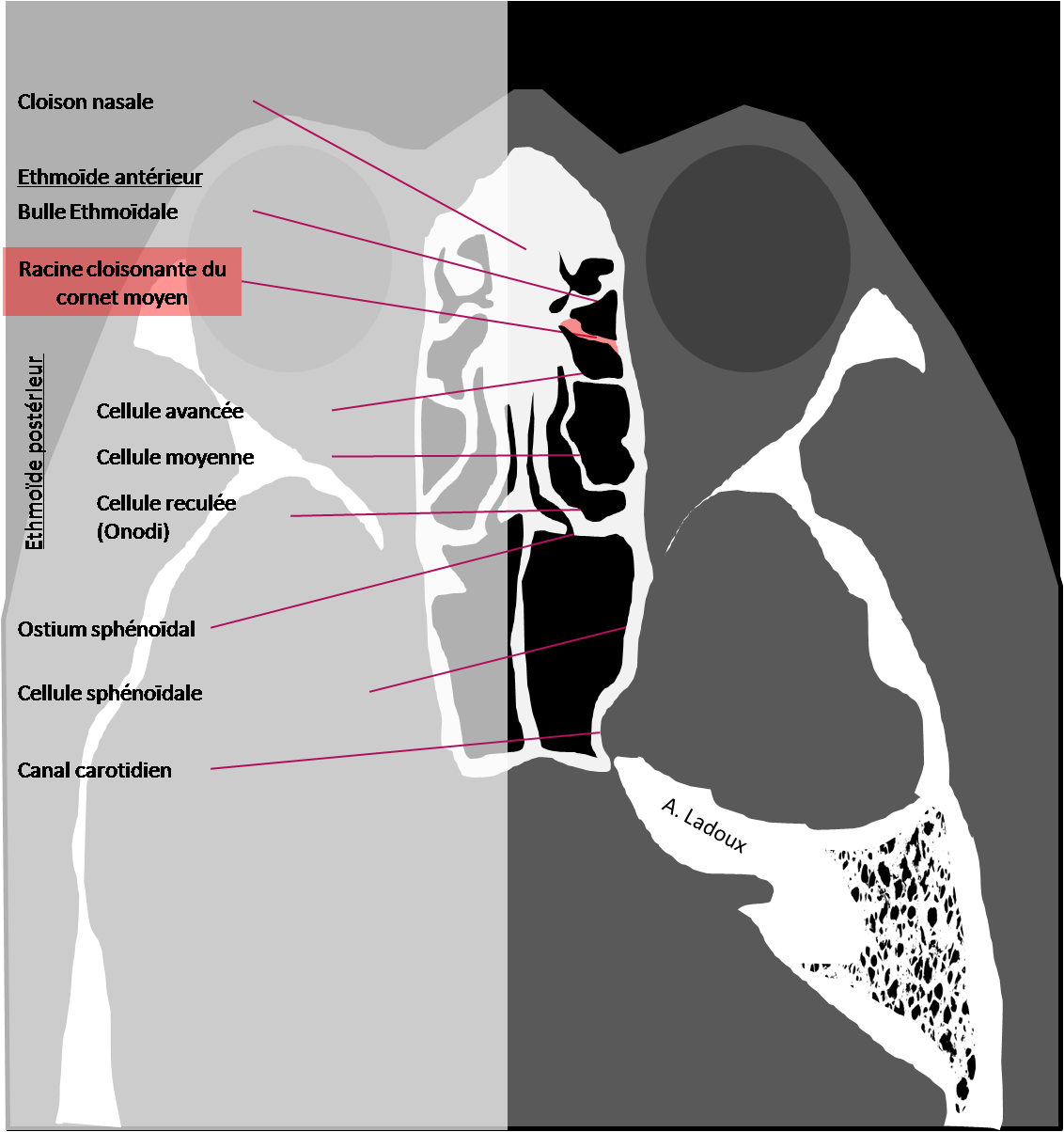
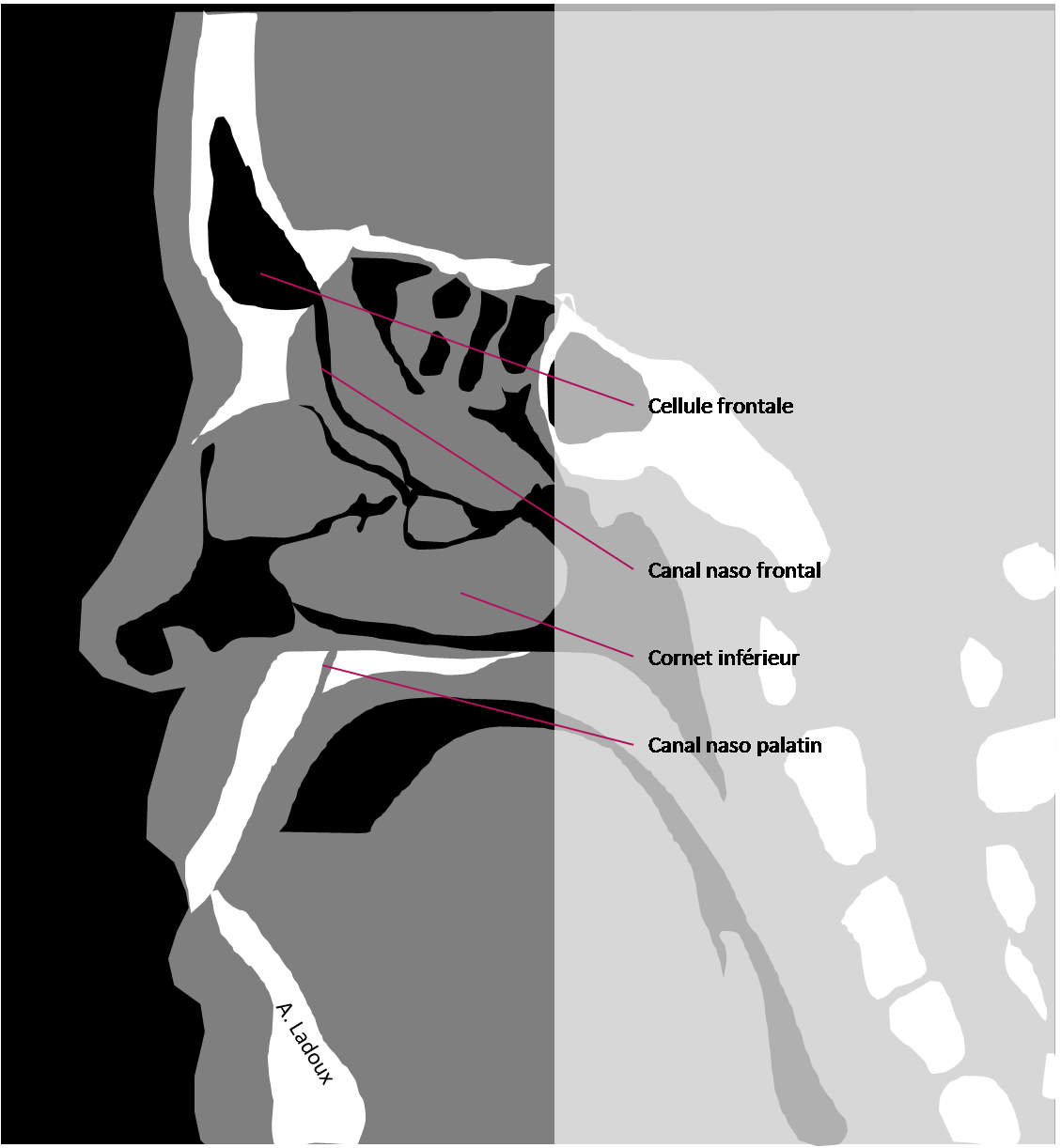
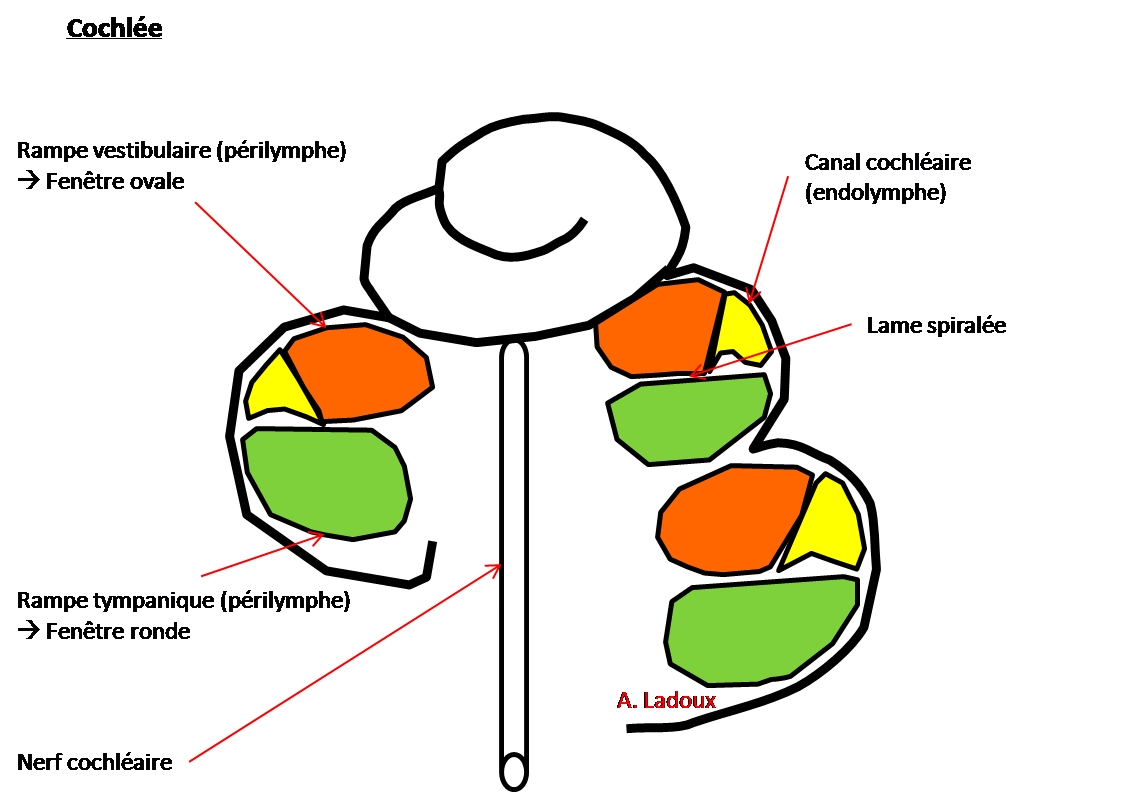

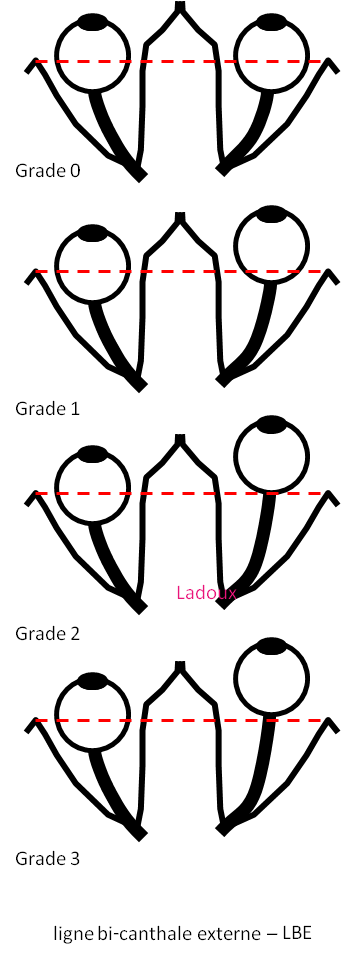
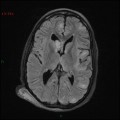
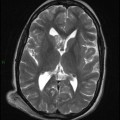
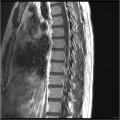
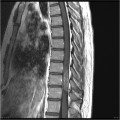
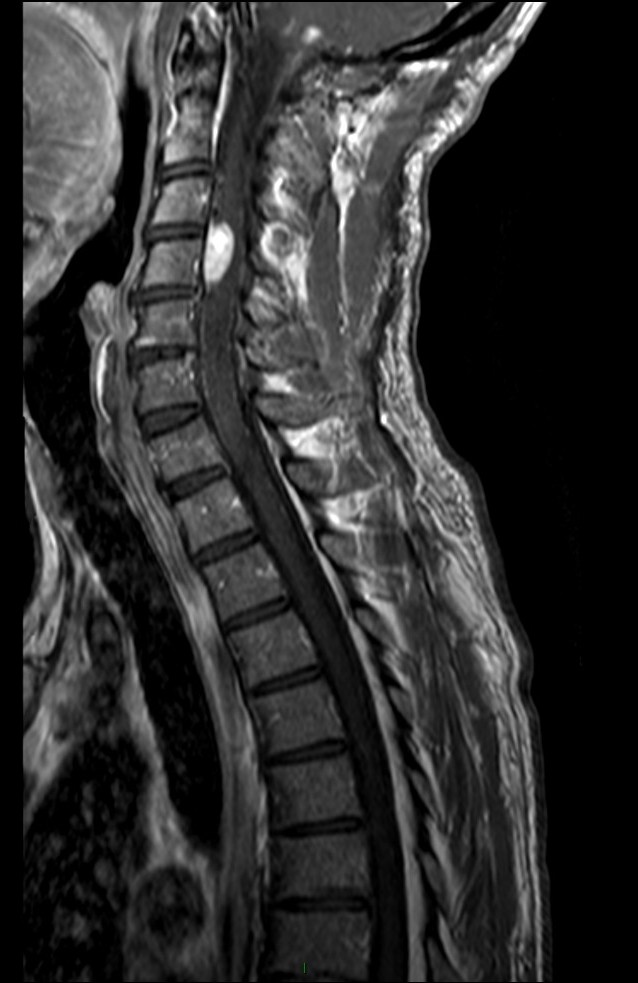
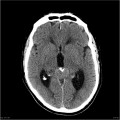
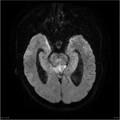
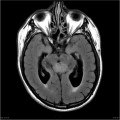
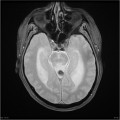
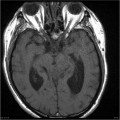
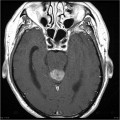
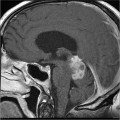
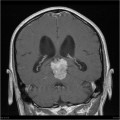
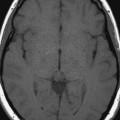
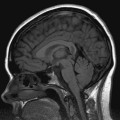
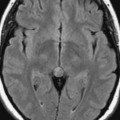
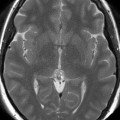
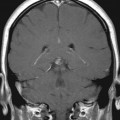
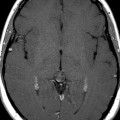
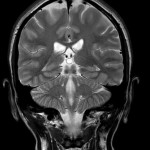
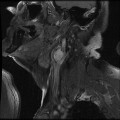
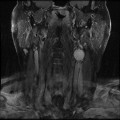
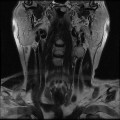
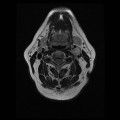
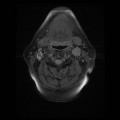
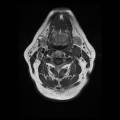
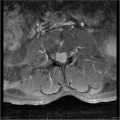
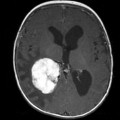
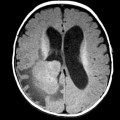
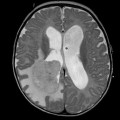
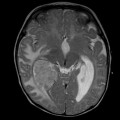
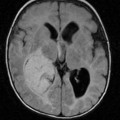
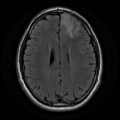
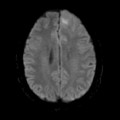
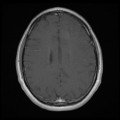
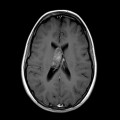
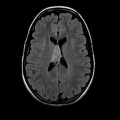
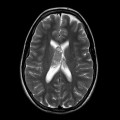
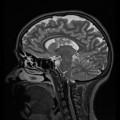
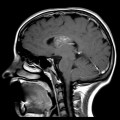
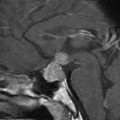
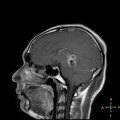
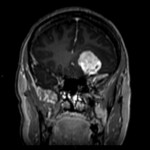
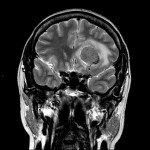
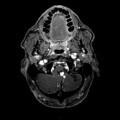
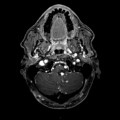
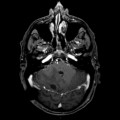
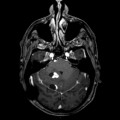
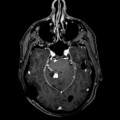
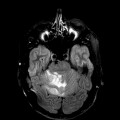
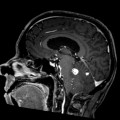
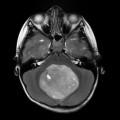
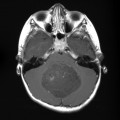
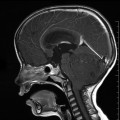
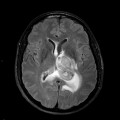
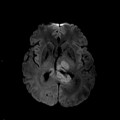
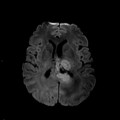
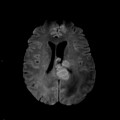
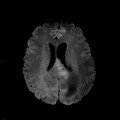
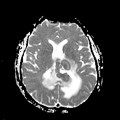
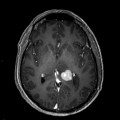
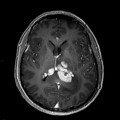
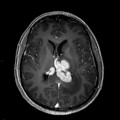
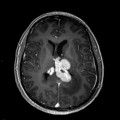
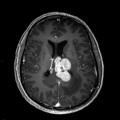
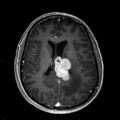
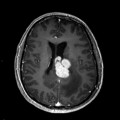
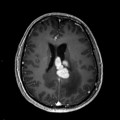
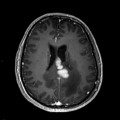
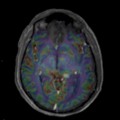
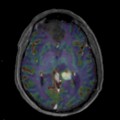
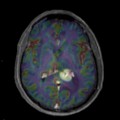
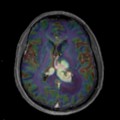
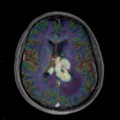
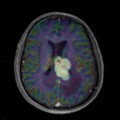
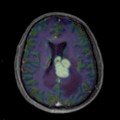
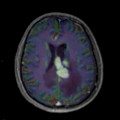
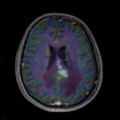
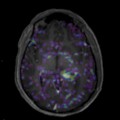
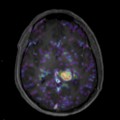
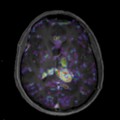
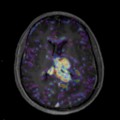
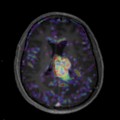
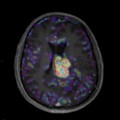
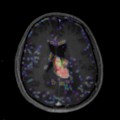
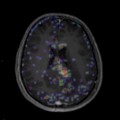
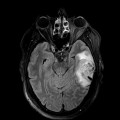
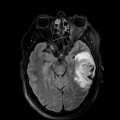
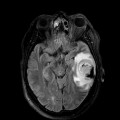
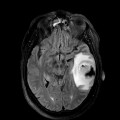
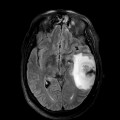
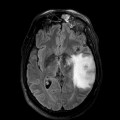
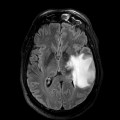
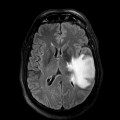
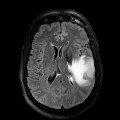
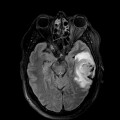
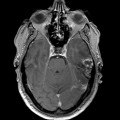
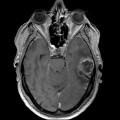
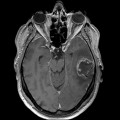
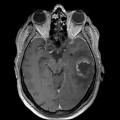
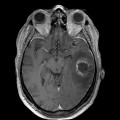
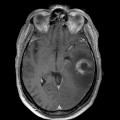
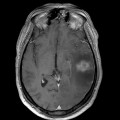
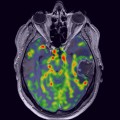
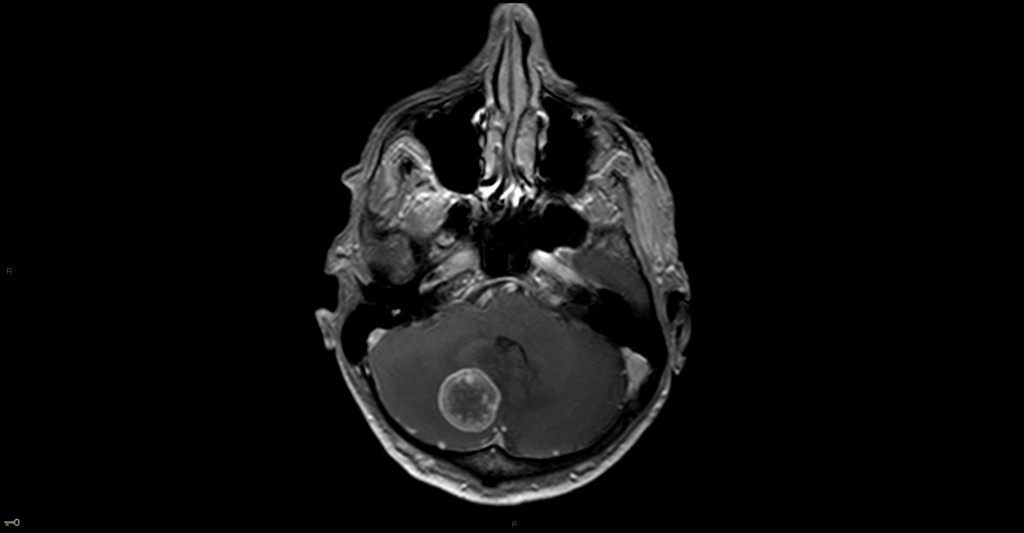
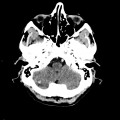
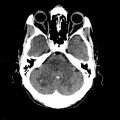
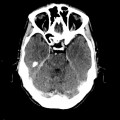
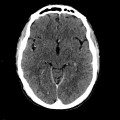
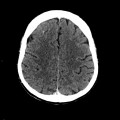
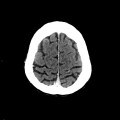
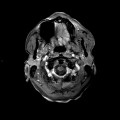
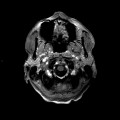
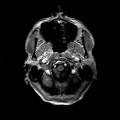
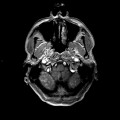
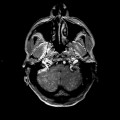
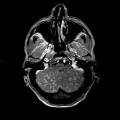
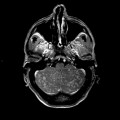
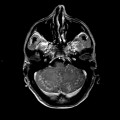
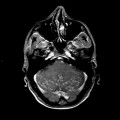
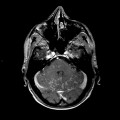
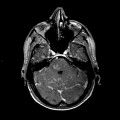
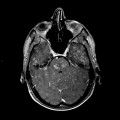
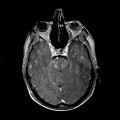
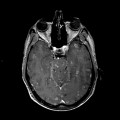
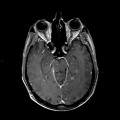
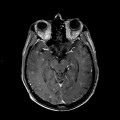
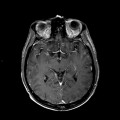
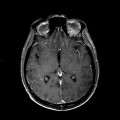
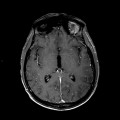
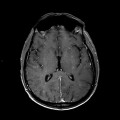
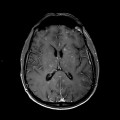
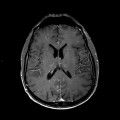
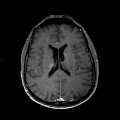
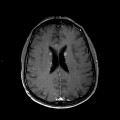
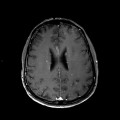
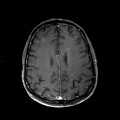
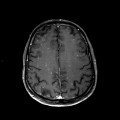
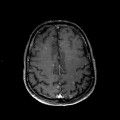
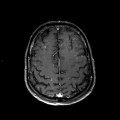
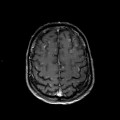
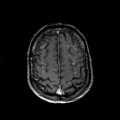
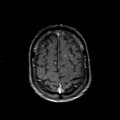
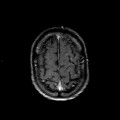
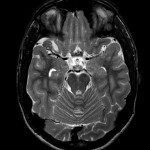
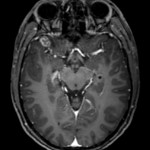
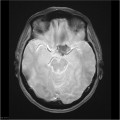
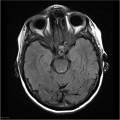
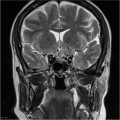
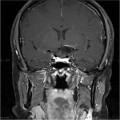
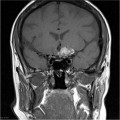
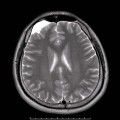
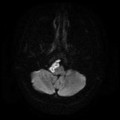
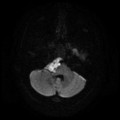
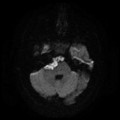
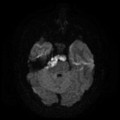
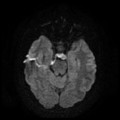
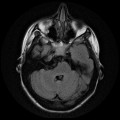
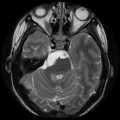
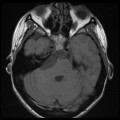
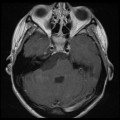
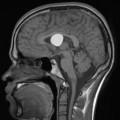
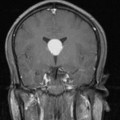
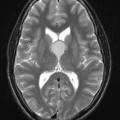
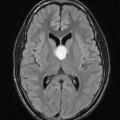
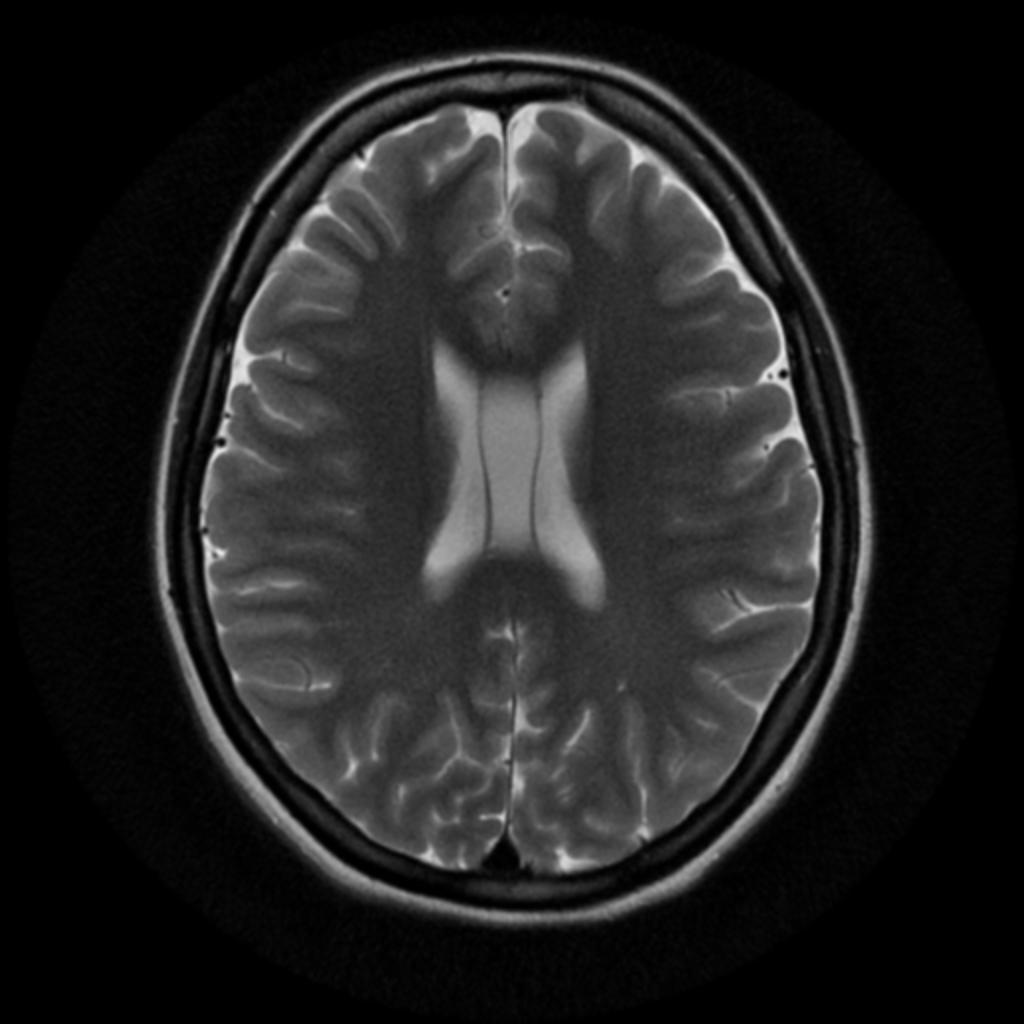
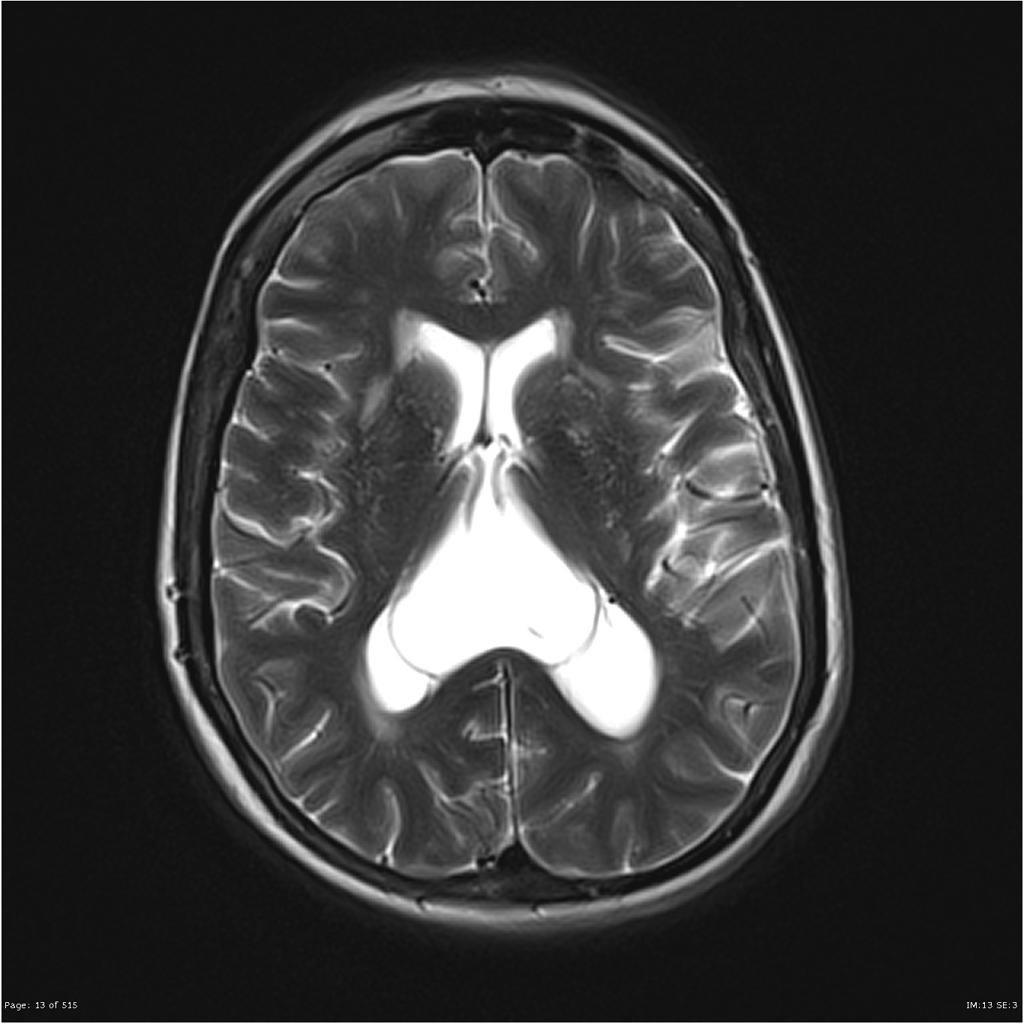
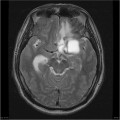
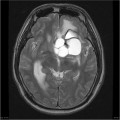
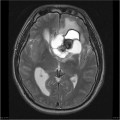
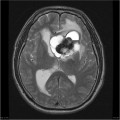
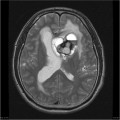
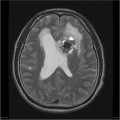
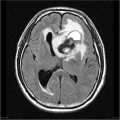
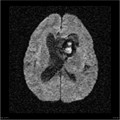
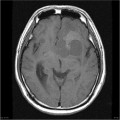
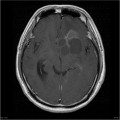
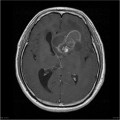
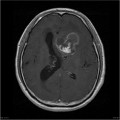
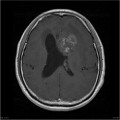
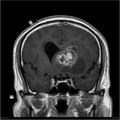
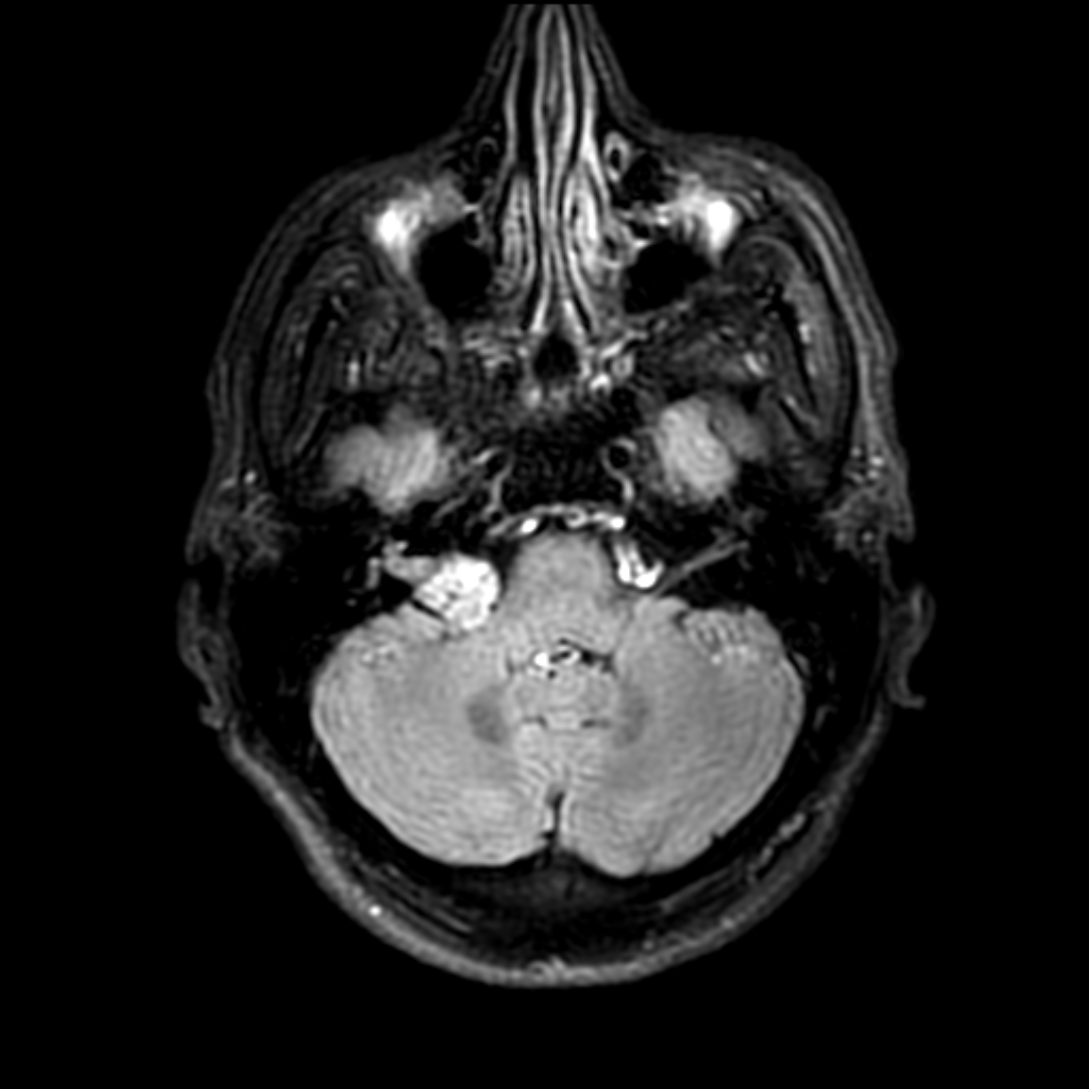
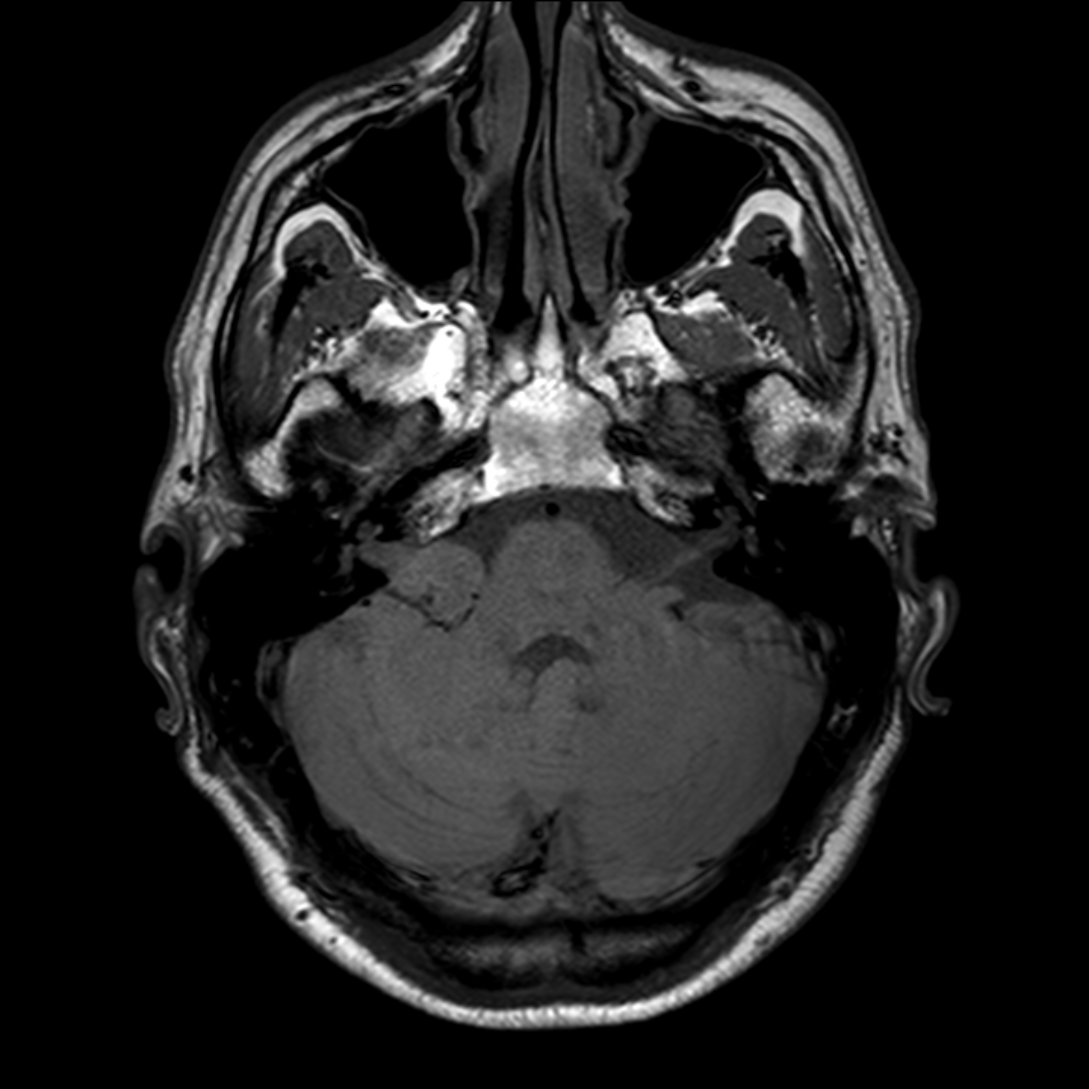
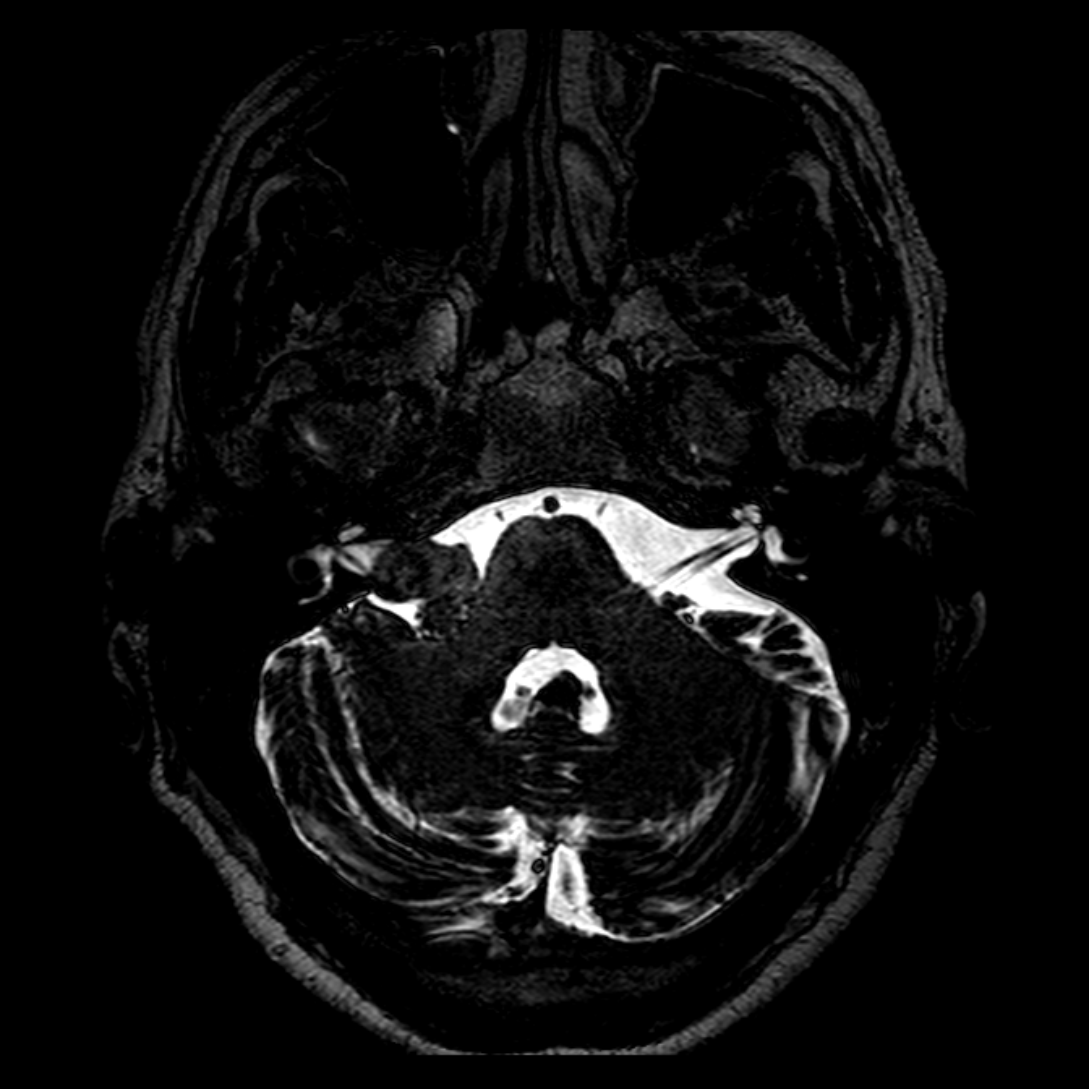
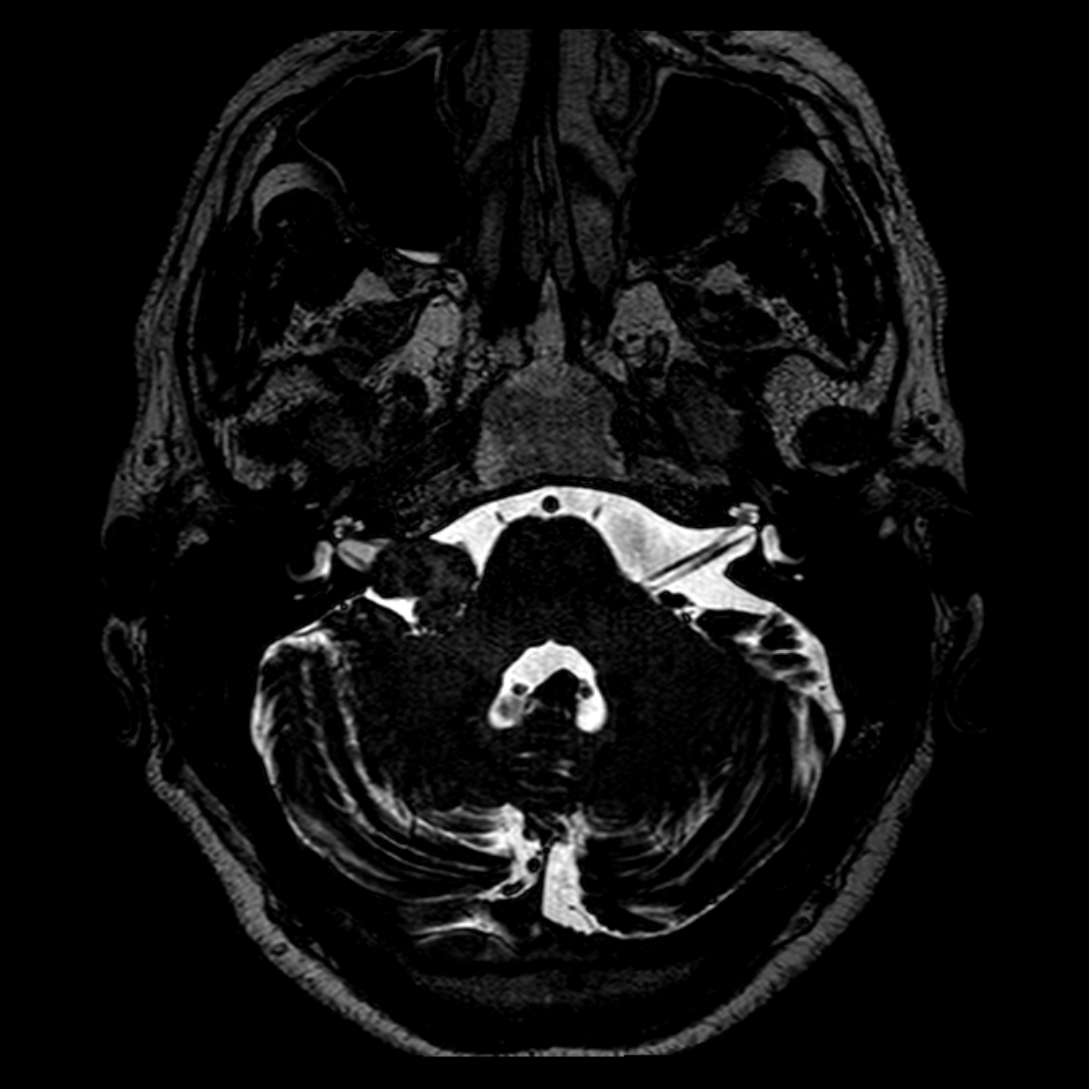
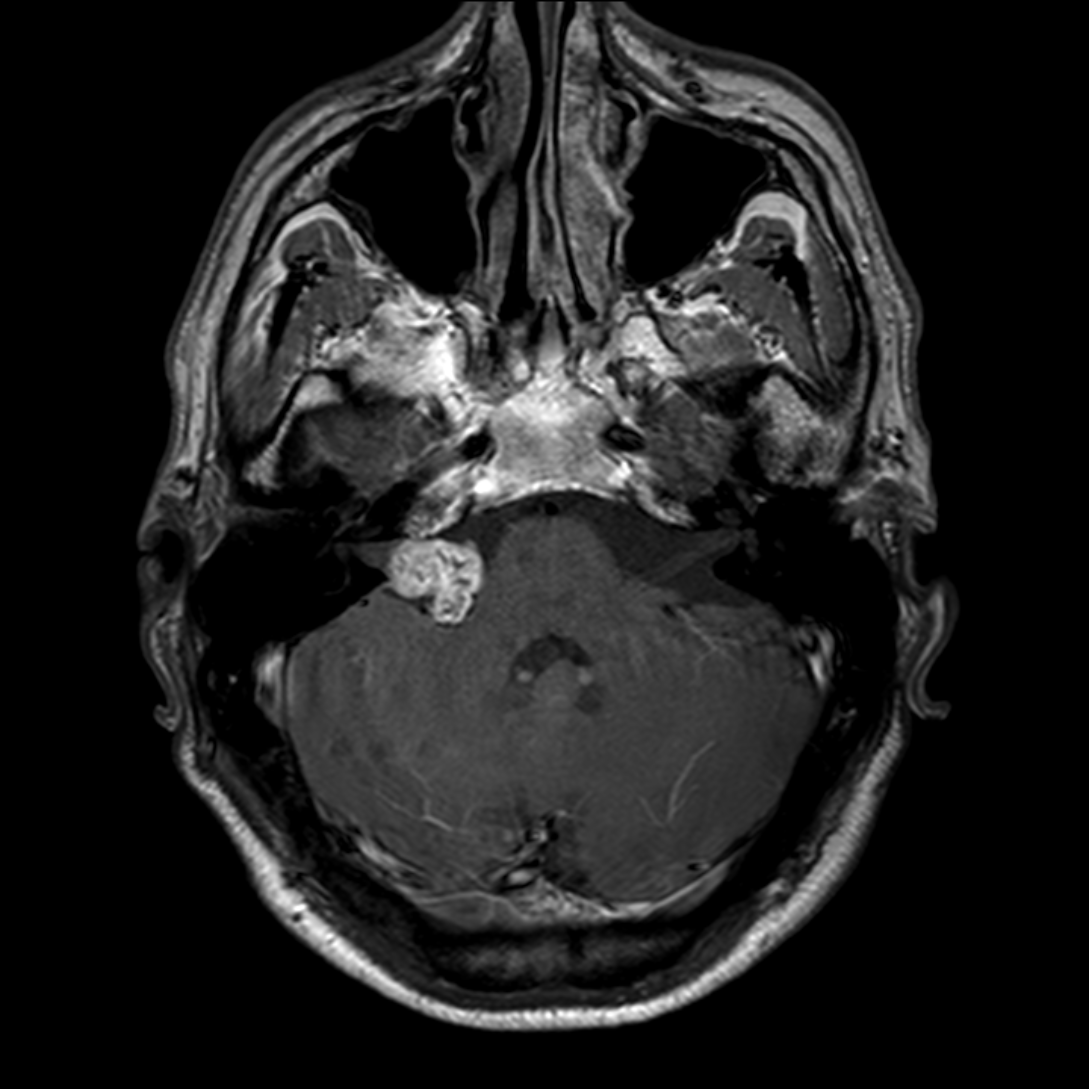
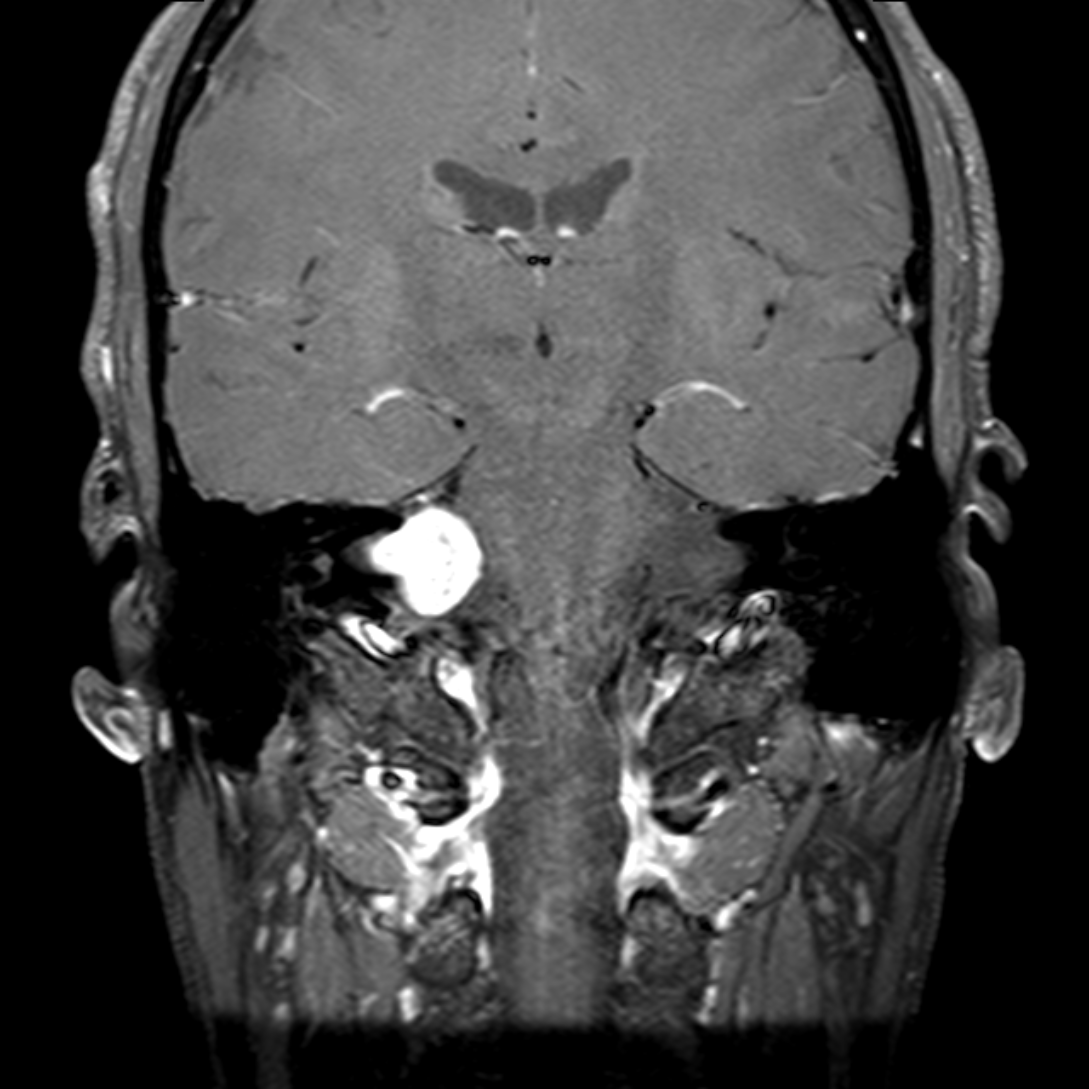
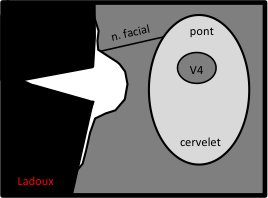
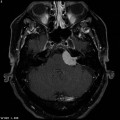
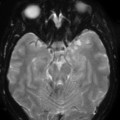
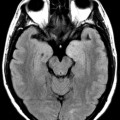
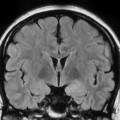
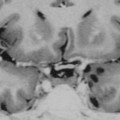

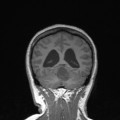
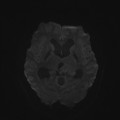
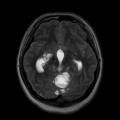
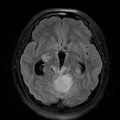
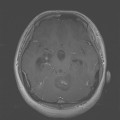
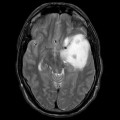
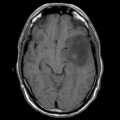
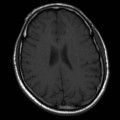
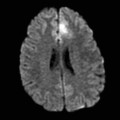
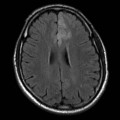

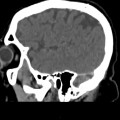
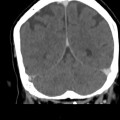
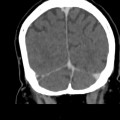
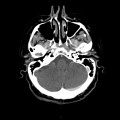
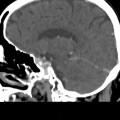
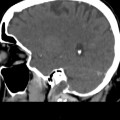
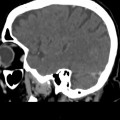
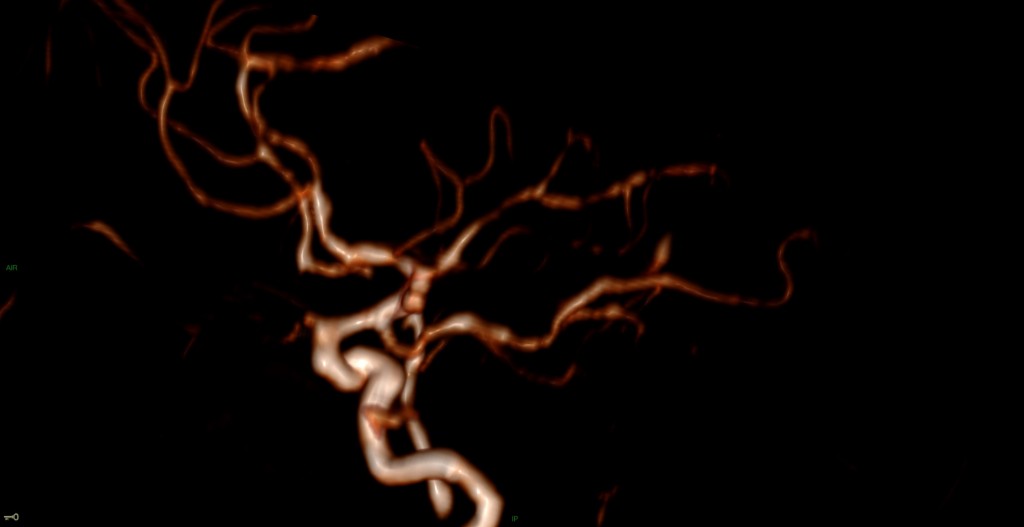
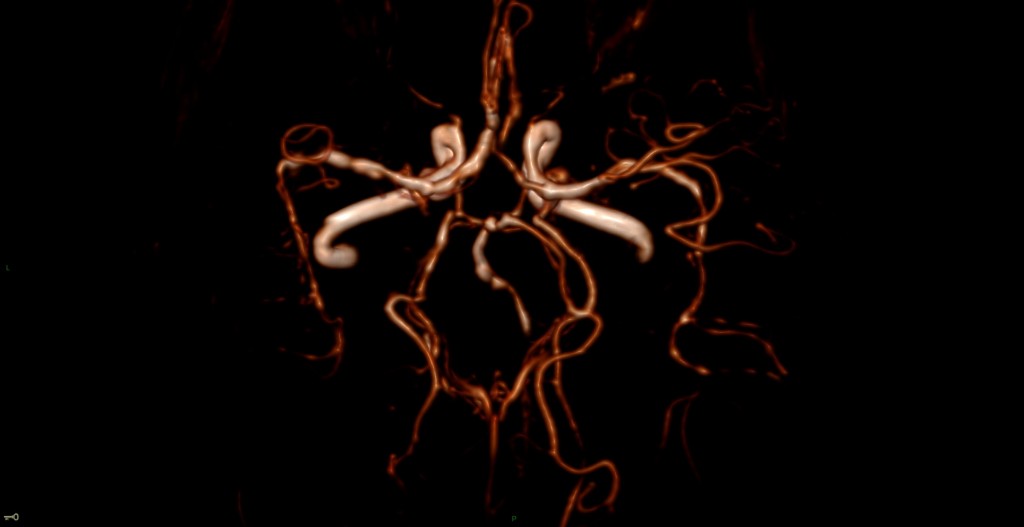
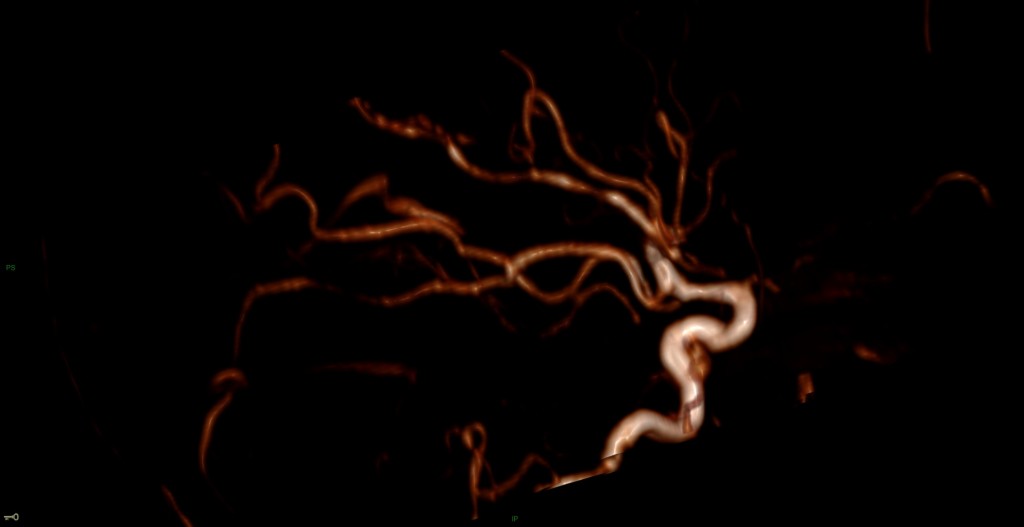
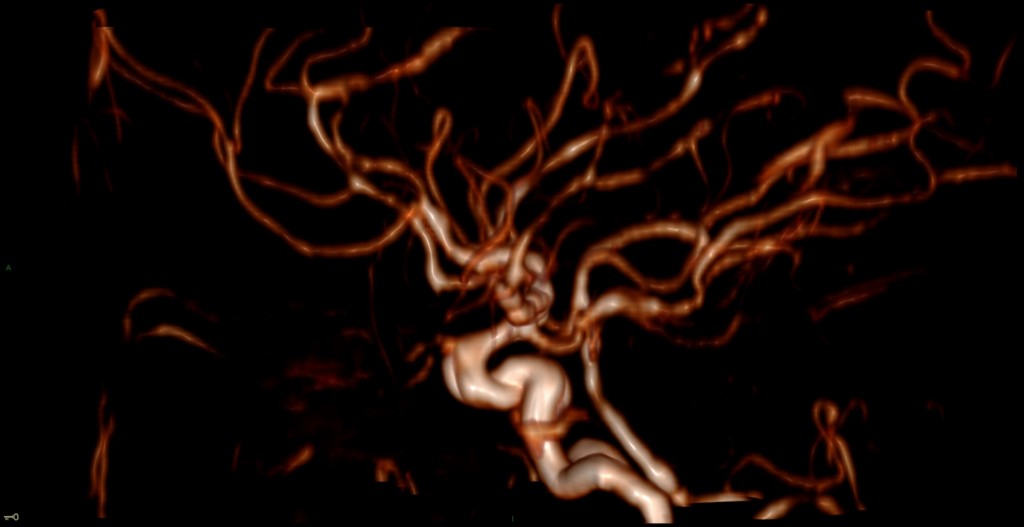
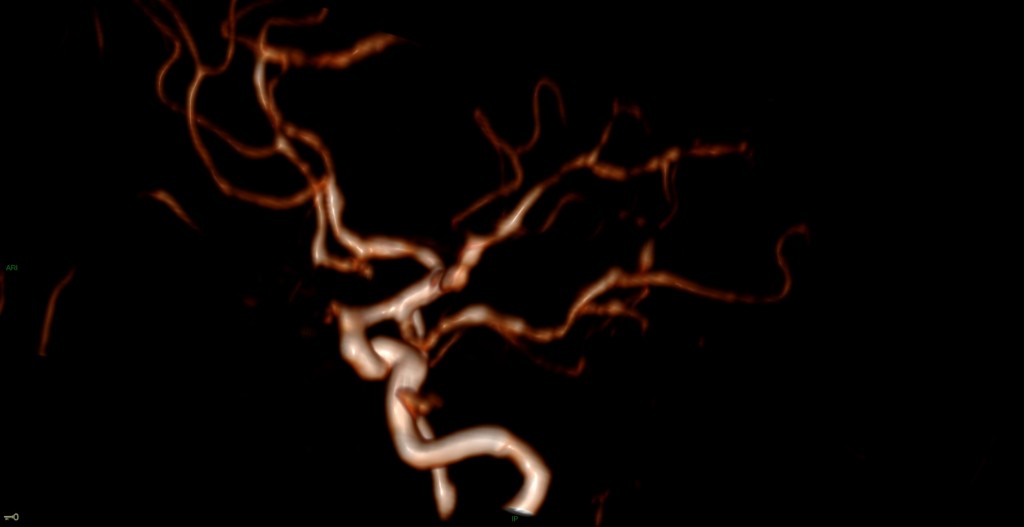
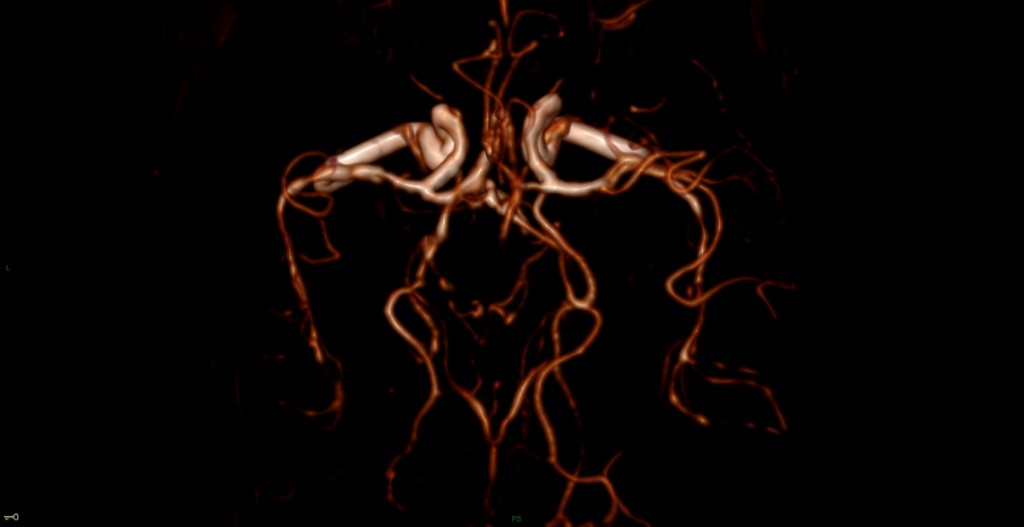
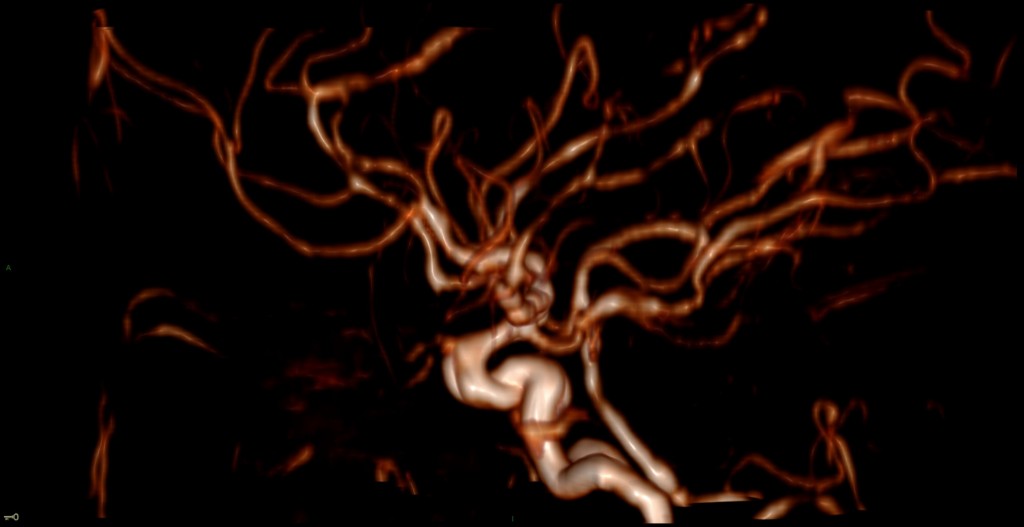
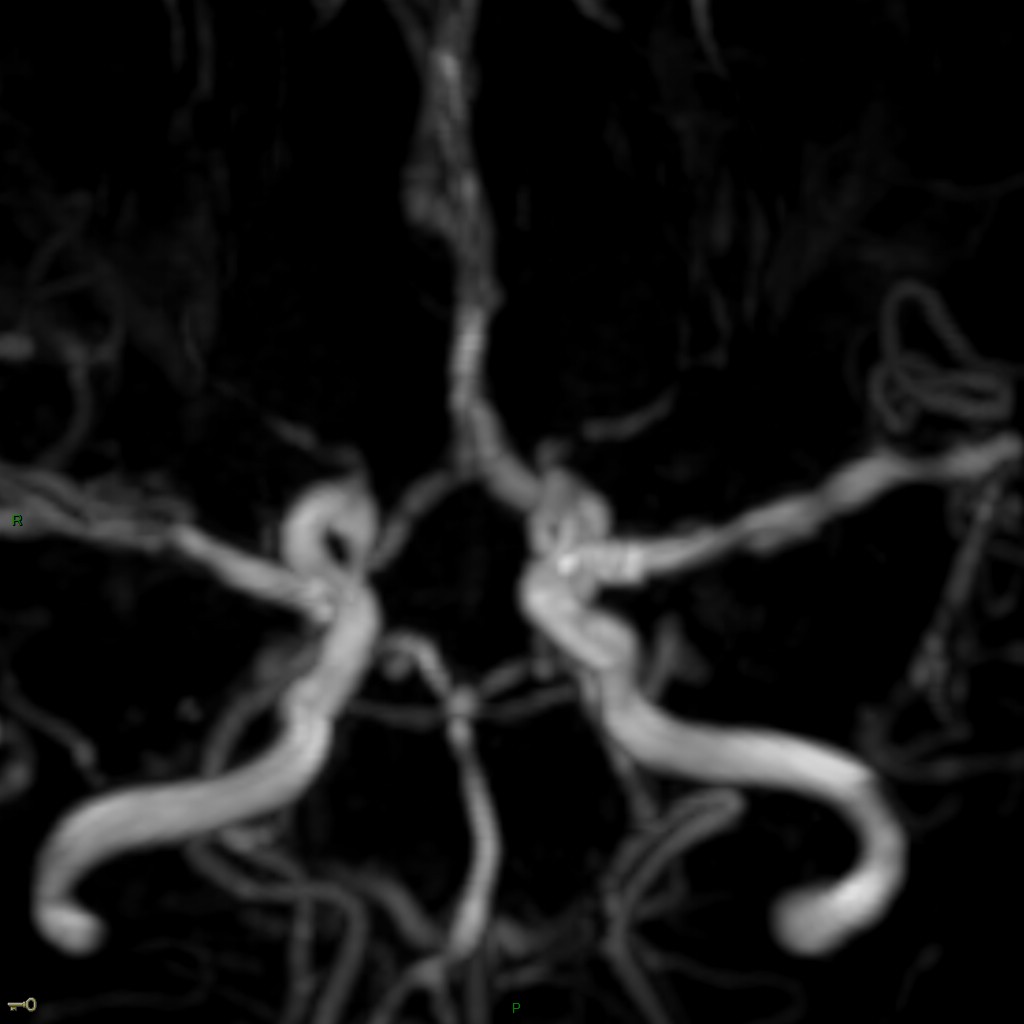
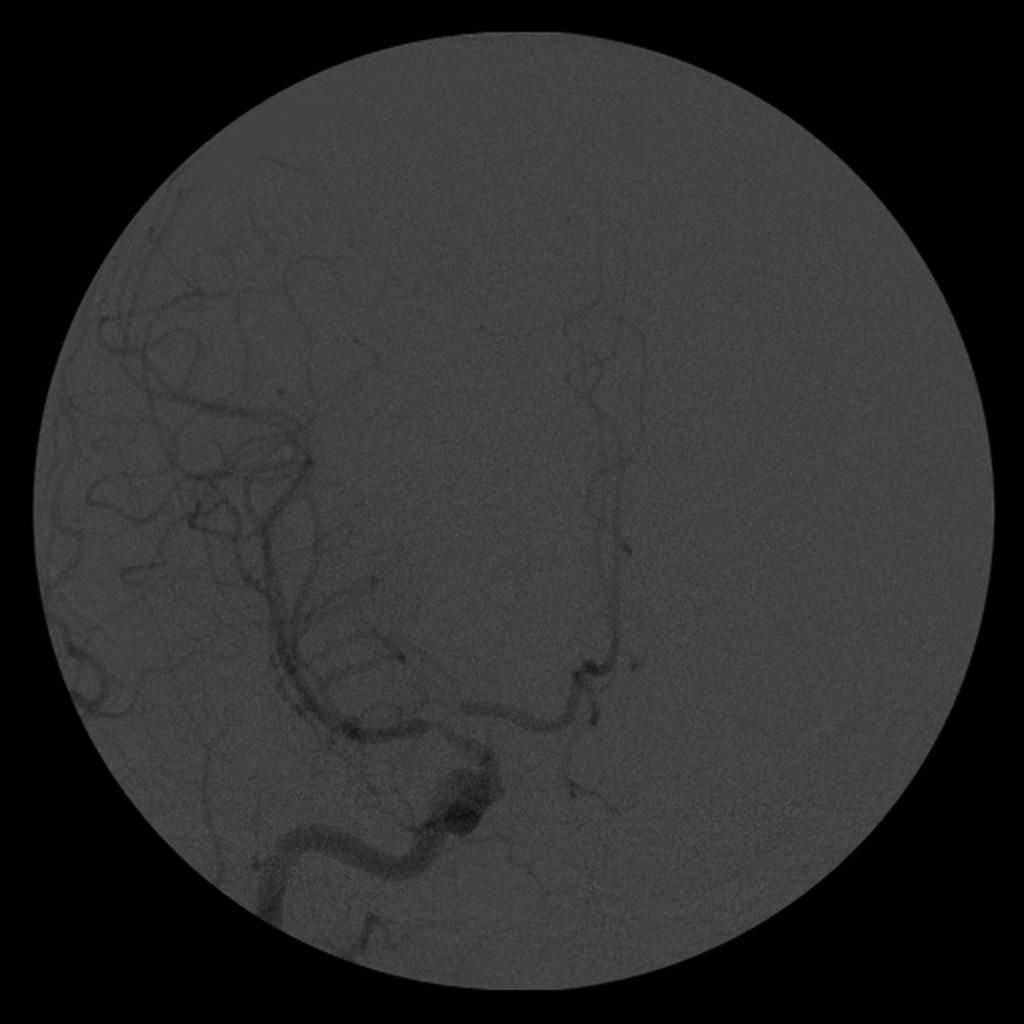




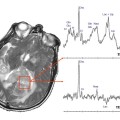
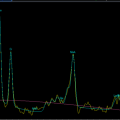
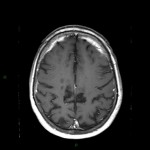
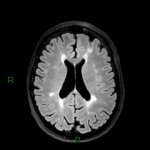
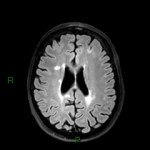
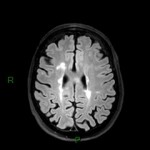
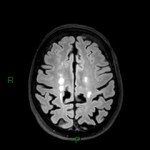
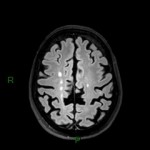
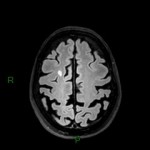
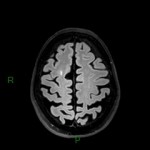
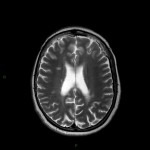
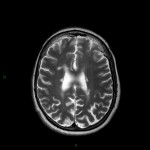
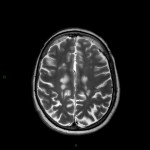
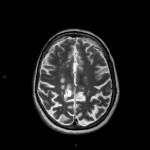
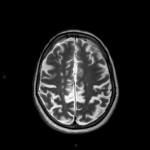
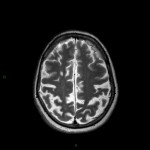

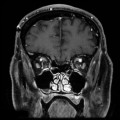
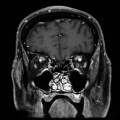
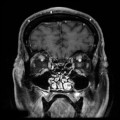
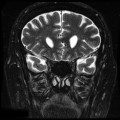
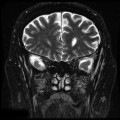
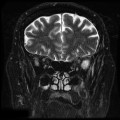
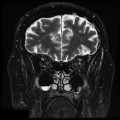
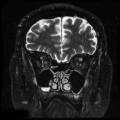
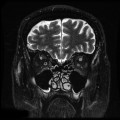
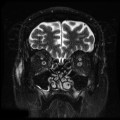
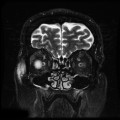
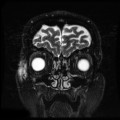
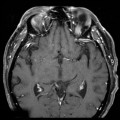
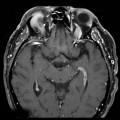
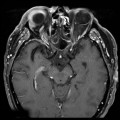
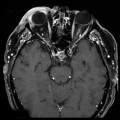
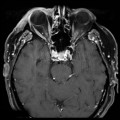
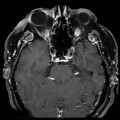
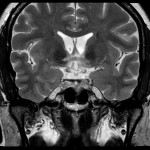
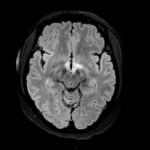
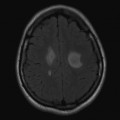
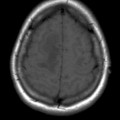
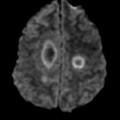
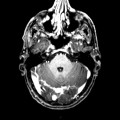
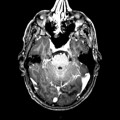
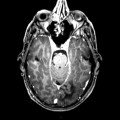
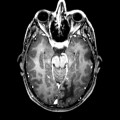
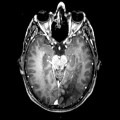
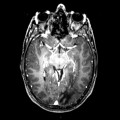
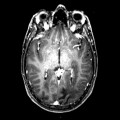
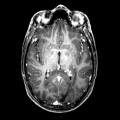
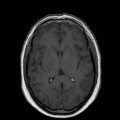
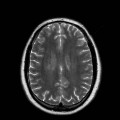
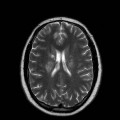
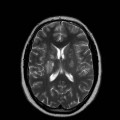
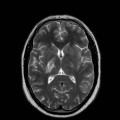
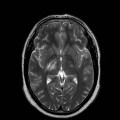
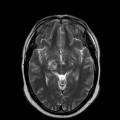
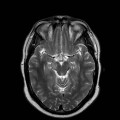
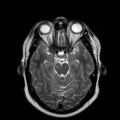
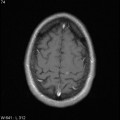
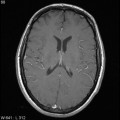
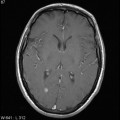
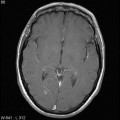
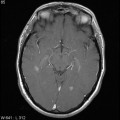
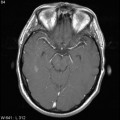
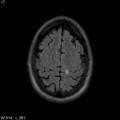
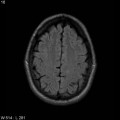
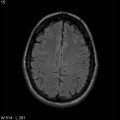
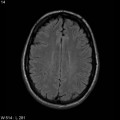
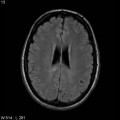
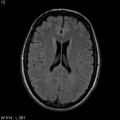
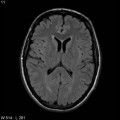
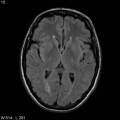
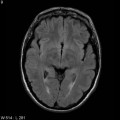
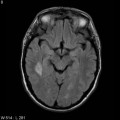
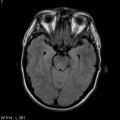
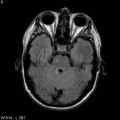
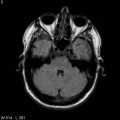
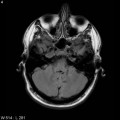
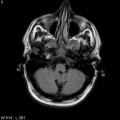
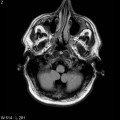
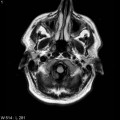

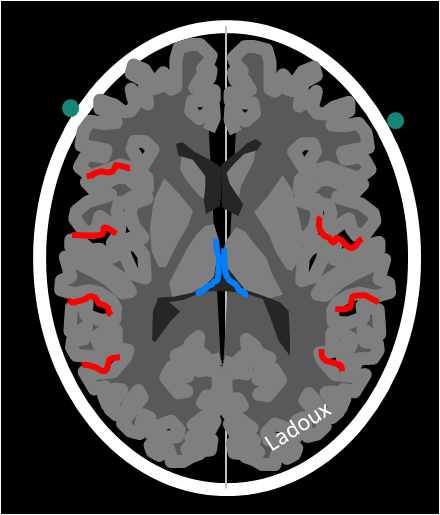 Mort encéphalique
Mort encéphalique

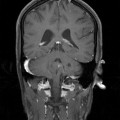
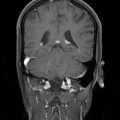
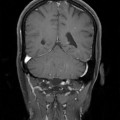
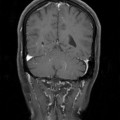
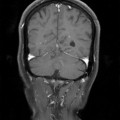
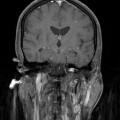
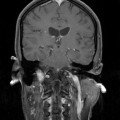
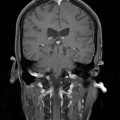
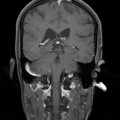
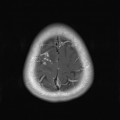
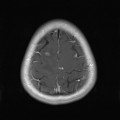
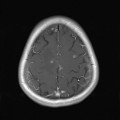
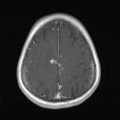
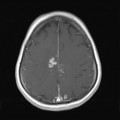
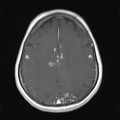
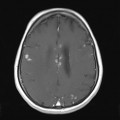
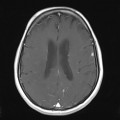
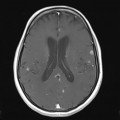
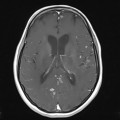
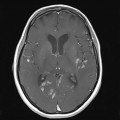
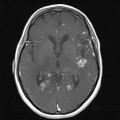
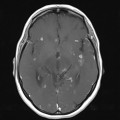
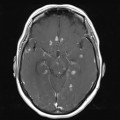
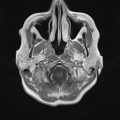
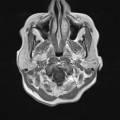
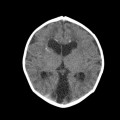
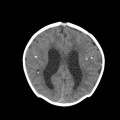
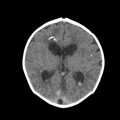
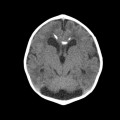
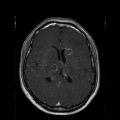
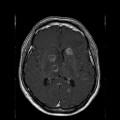
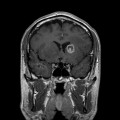
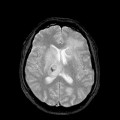
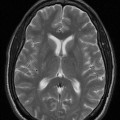
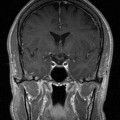
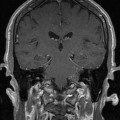
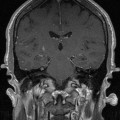
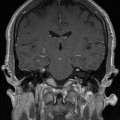
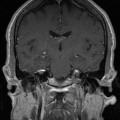
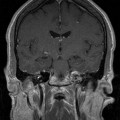
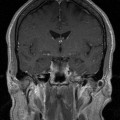
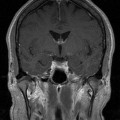
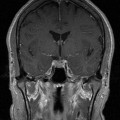
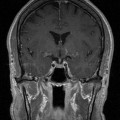
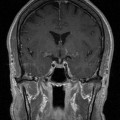
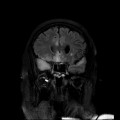
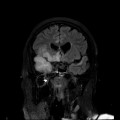
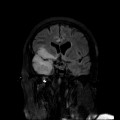
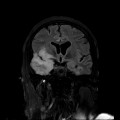
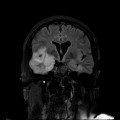
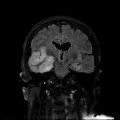
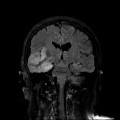
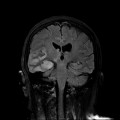
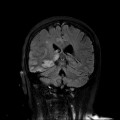
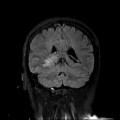
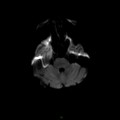
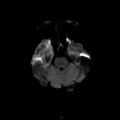
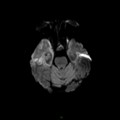
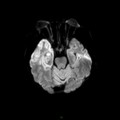
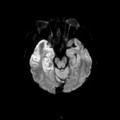
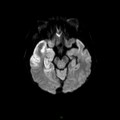
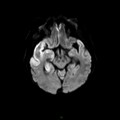
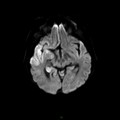
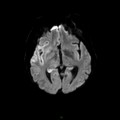
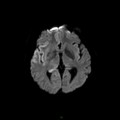
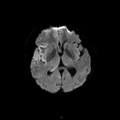
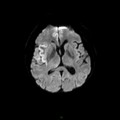
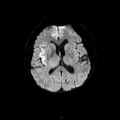
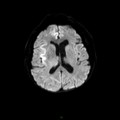
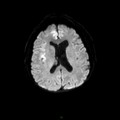
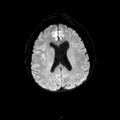
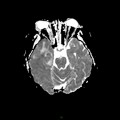
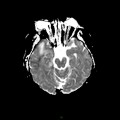
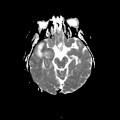
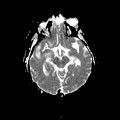
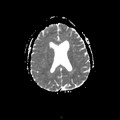
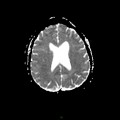
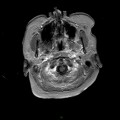
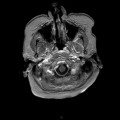
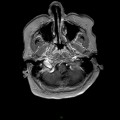
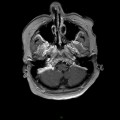
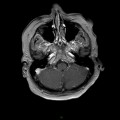
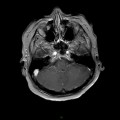
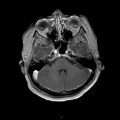
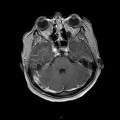
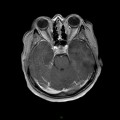
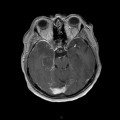
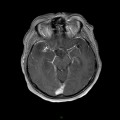
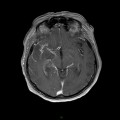
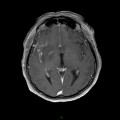
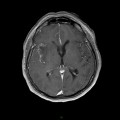
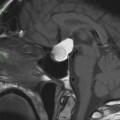
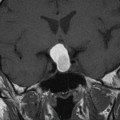
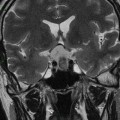
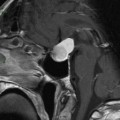
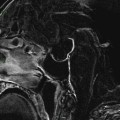
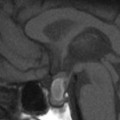
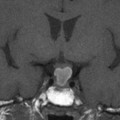
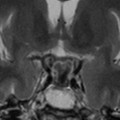
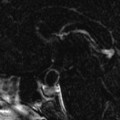
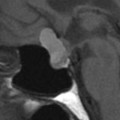
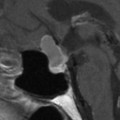
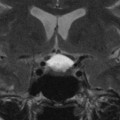
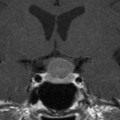
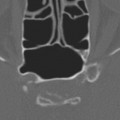
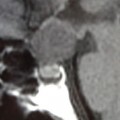
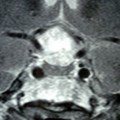
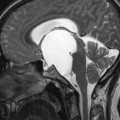
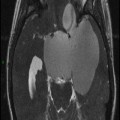
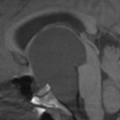
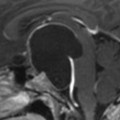
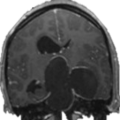
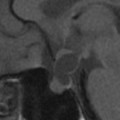
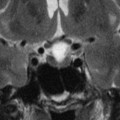
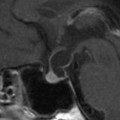
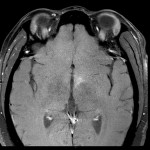
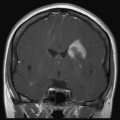
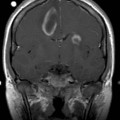
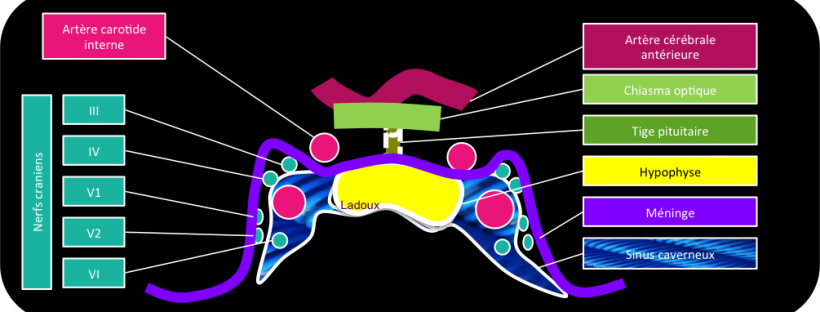 Coupe coronale centrée sur la selle turcique
Coupe coronale centrée sur la selle turcique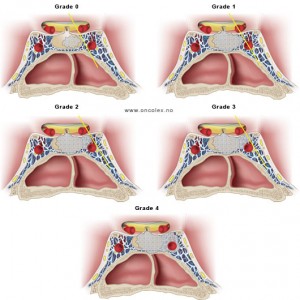
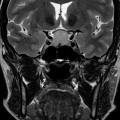
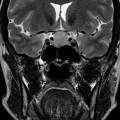
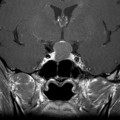
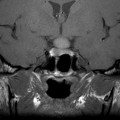
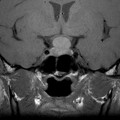
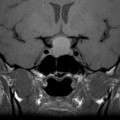
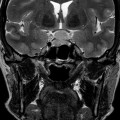
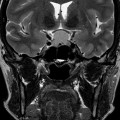
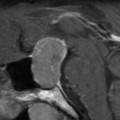
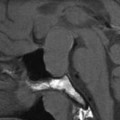
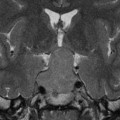
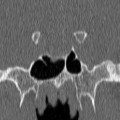
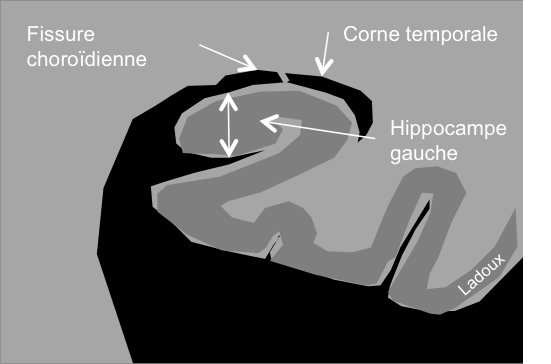
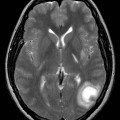
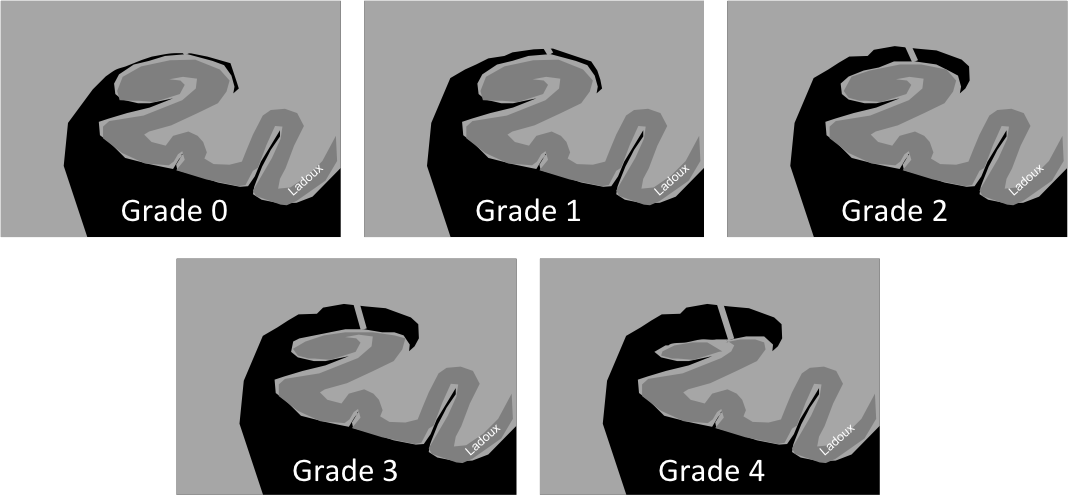 Echelle de Scheltens (atrophie hippocampique)
Echelle de Scheltens (atrophie hippocampique)
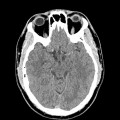
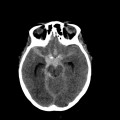
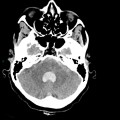
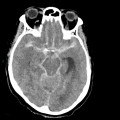
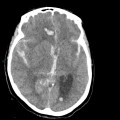
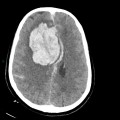
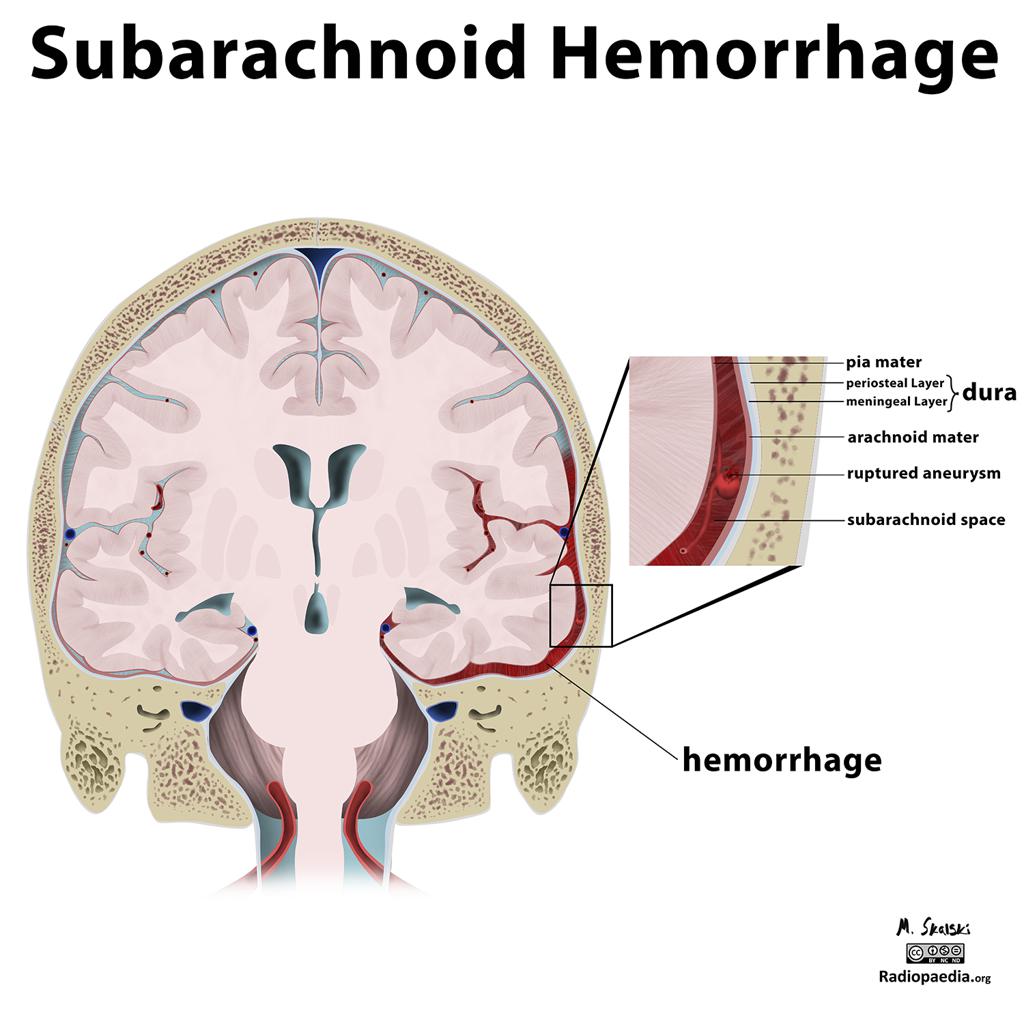
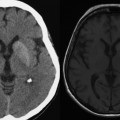
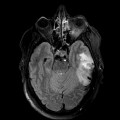
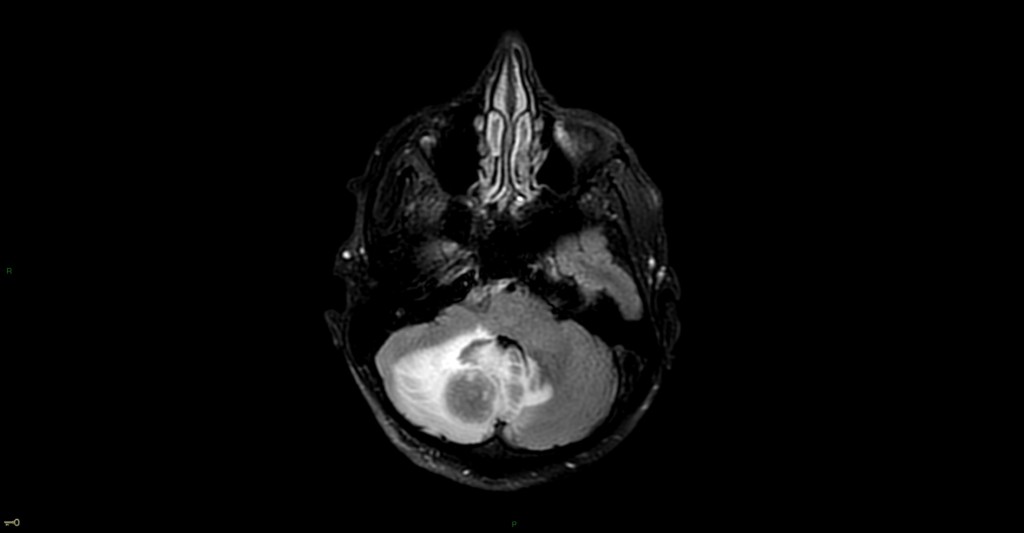
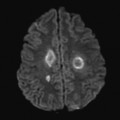
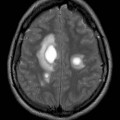
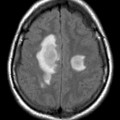
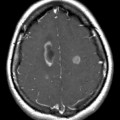
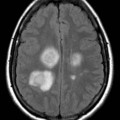
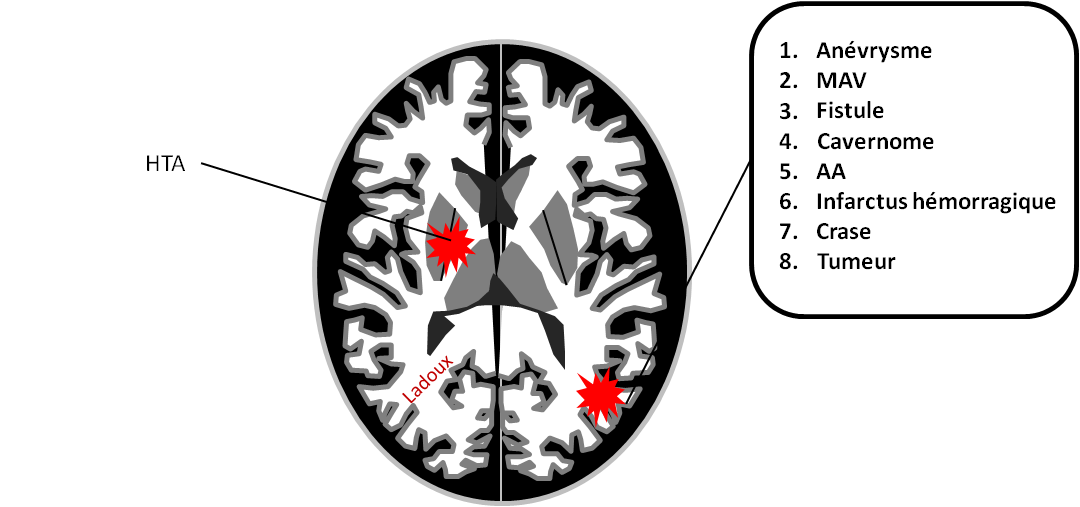 Hématomes cérébraux intra parenchymateux
Hématomes cérébraux intra parenchymateux