Cholangiocarcinome : cancer primitif des voies biliaires
|
Différentes formes de Cholangiocarcinome
|
DDx
|
Critères de non résécabilité
|
Bilan d’extension des cholangiocarcinome
|
Cholangiocarcinome : cancer primitif des voies biliaires
|
Différentes formes de Cholangiocarcinome
|
DDx
|
Critères de non résécabilité
|
Bilan d’extension des cholangiocarcinome
|

Case courtesy of Ed Uthman, Radiopaedia.org. From the case rID: 8480
Développement lent
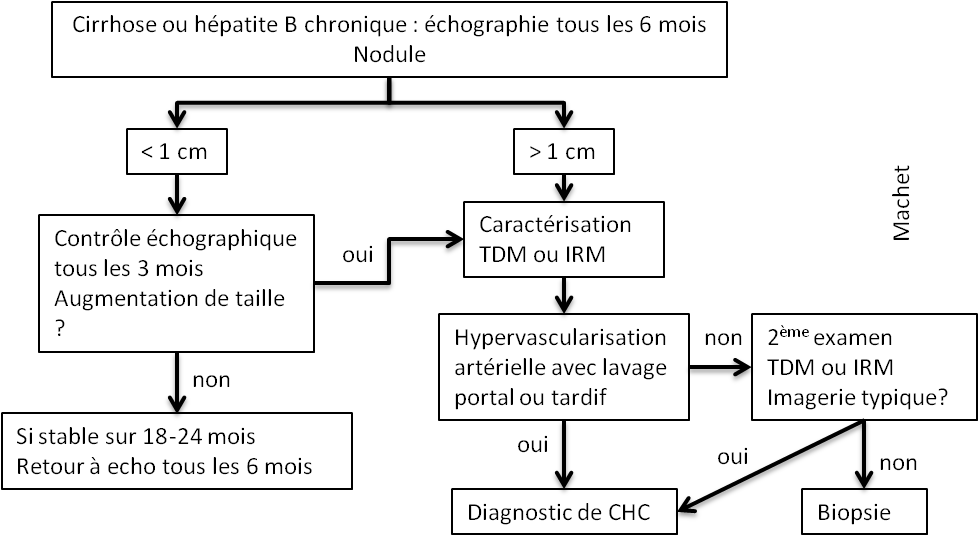
Protocole de perfusion cérébrale IRM |
|
|
 |
Technique
|
OBJECTIFS DE LA PERFUSION CÉRÉBRALE pour les tumeurs
|
Exploration des tumeurs par perfusion cérébrale |
|
— Cut off à 1,75 —
|
|
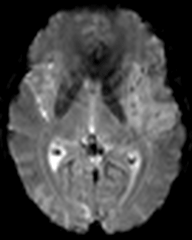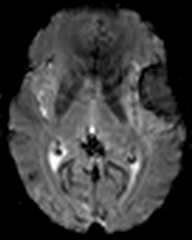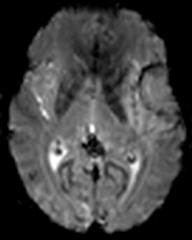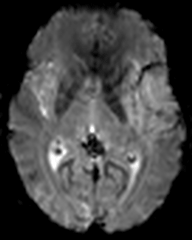
Exploration de la pathologie VASCULAIRE par perfusion cérébrale |
|
Recherche d’un mismatch diffusion / perfusionIschémie si Tmax > 6s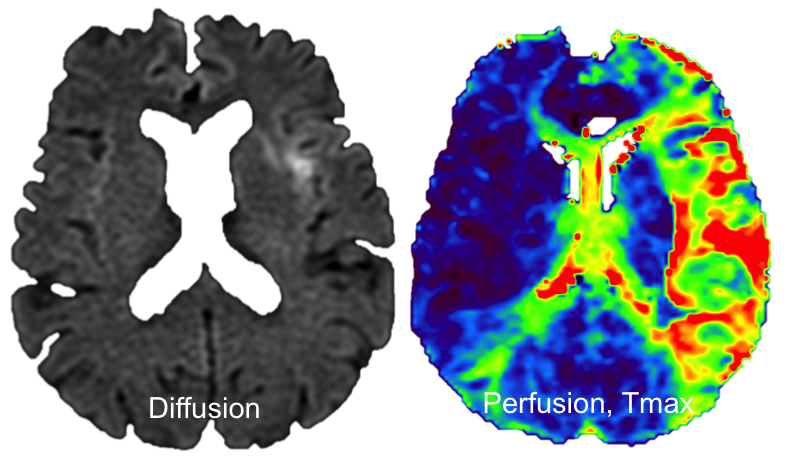 |
|
IRM : protocole d’exploration des tumeurs des glandes salivaires
|
Pathologies des glandes salivaires
|
DÉMARCHE diagnostique devant une tumeur des glandes salivaires
|
| BENIN [80%] | MALIN [20%] | |
| Contours | Bien limités | Mal limités |
| Signal | hyperT2 liquidien | hypoT2 |
| Nécrose centrale | – | + |
| Capsule périphérique hypoT2 | + le plus souvent adénome pléiomorphe) |
– |
| Envahissement de voisinage | – | Infiltration de la graisse |
| Adénopathie | – | + |
| Infiltration périneurale | – | + |
| ADC relatif | élevé (>1.3) sauf CAL | bas ( < 1.0) |
ALGORITHME DIAGNOSTIQUE |
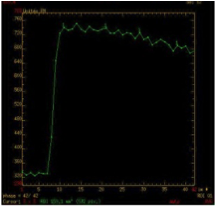
Courbes de perfusion des tumeurs des glandes salivaires |
|
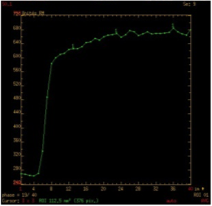
| Type A : Plateau ascendant Adénome pléomorphe cellulaire ou non |
 |
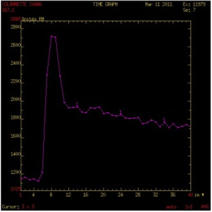
| Type B : Prise de contraste rapide et wash-out > 30% Tumeur de Warthin |
 |
| Type C : Prise de contraste rapide avec plateau ou wash-out < 30 % Courbe aspécifique |
 |
| Histologie | Clinique | IRM |
| Adénome pléomorphe (3/4 des tumeurs parotide) |
|
|
| Tumeur de Warthin (Anciennement cystadénolymphome) |
|
|
Tumeur maligne :
|
|
|
Diagnostics différentiels |
|
|
Syndrome de Gougerot-Sjögren (syndrome sec) |
|
|
Ganglion intra parotidien |
|
|
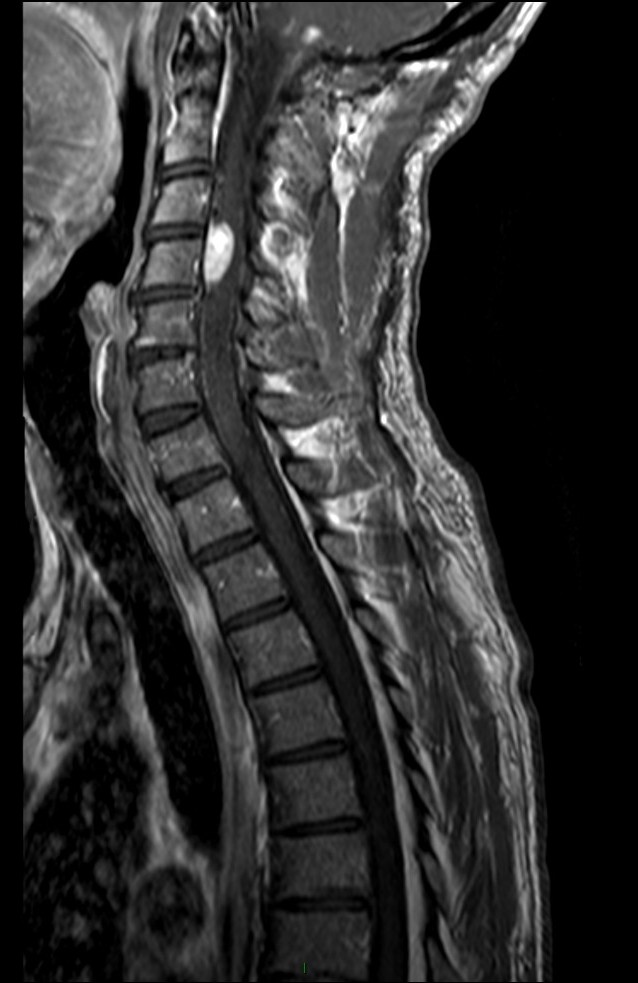
Tumeurs rachidiennes intra durales – intra médullaires |
||
|
||
Ependymome
|
|
|
Astrocytome
|
|
|
Hémangioblastome |
 |
|
Lymphome
|
||
Cavernome |
||
Tumeurs rachidiennes intra durales – extra médullaires |
||
|
||
Méningiome
|
||
Tumeurs des gaines nerveusesSchwannome
Neurofibrome
Ganglioneurome |
||
Paragangliome
|
||
Métastases intradurales
|
||
Tumeurs rachidiennes extra durales |
||
Refoulement et compression de la moelleEffacement progressif des espaces sous arachnoïdiensInfiltration de la graisse épidurale aux pôles de la lésion
DDx: spondylodiscite, hématome péridural |
||
Métastases
|
||
Causes des PDC DES RACINES DE LA QUEUE DE CHEVAL
|
Protocole scanner
|
Densité spontanée
|
MESURE DU WASH OUT RELATIF AU SCANNER
|
||||
| (UHportal-UHtardif) —————————- x 100 (UHportal) |
|
| > 40% ⇒ adénome (Se96%, Sp100%) < 40% ⇒ faire IRM |
|
Critères scanographiques pour affirmer l’adénome
Tumeur de densité lipidiques + pseudocloisons + calcifications ponctiformes = myélolipome |
Protocole IRM
|
MESURE DU WASH OUT RELATIF EN IRM
|
||||
| (Sinphase-Soutphase)/Sinphase x 100 | |
| >20% ⇒ adénome | |
En absence de contexte cancer : 2-10% incidentalomes sur les examens
| LÉSION | CARACTÉRISTIQUES | IMAGERIE | |
| ADÉNOME |
|
|
|
|
|||
| MÉTASTASE |
|
|
|
|
|||
| PHÉOCHROMOCYTOME |
|
|
|
|
|||
| MYELOLIPOME |
|
|
|
|
|||
| KYSTE |
|
|
|
|
|||
| HÉMATOME |
|
|
|
|
|||
| HYPERPLASIE BILATÉRALE DES SURRÉNALES |
Hyperaldostéronisme primaire |
|
|
|
|||
| CORTICOSURRENALOME |
|
|
|
|
|||
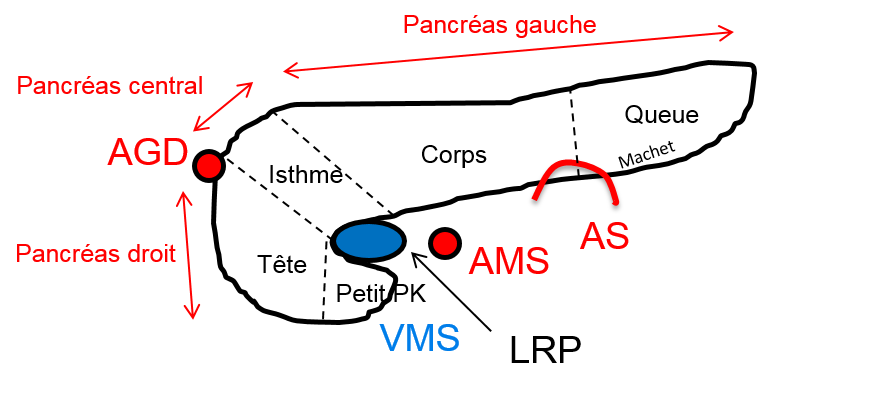
Protocole d’exploration des tumeurs du pancréas
|
Critères sémiologiques des tumeurs du pancréas
|
Compte rendu d’exploration des tumeurs du pancréas doit mentionner
|