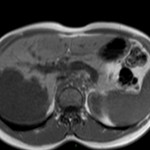
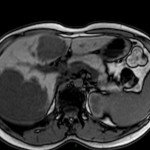
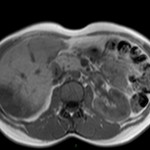
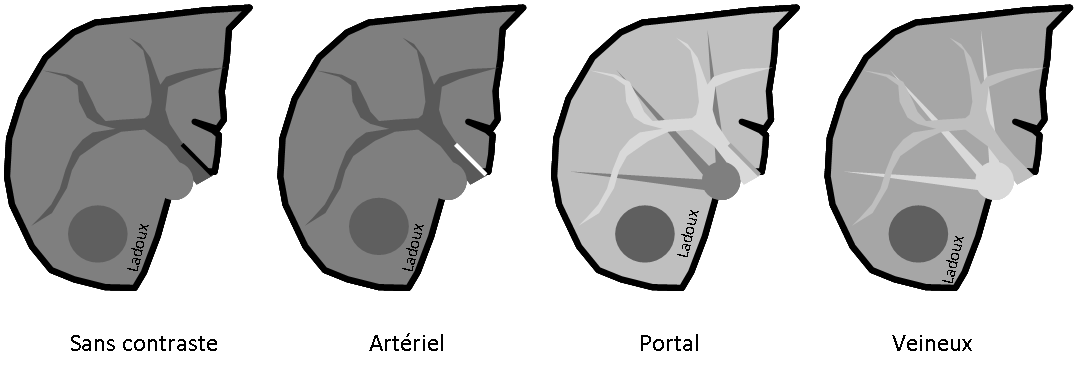
ECHOGRAPHIE PELVIENNE
INDICATION
Patiente âgée de X ans. Gestité X Parité X.
Actuellement au Xe jour du cycle menstruel.
Traitement hormonal : oui / non.
Exploration d’une douleur pelvienne, d’une méno-métrorragie.
TECHNIQUE
Echographie réalisée par voie sus-pubienne puis endovaginale.
RESULTATS
Utérus antéversé rétroversé antéfléchi rétrofléchi médian latéro-dévié à droite à gauche, de taille et de morphologie normale, mesurant H mm de hauteur, E mm d’épaisseur et L mm de largeur.
Endomètre hyperéchogène fin et régulier en rapport avec le cycle (épaisseur m).
Zone jonctionnelle régulière et fine, sans lésion d’adénomyose décelée.
Myomètre homogène sans lésion myomateuse individualisée.
Ovaire droit de morphologie normale (surface X cm2) pluri-folliculaire sans lésion focale.
Ovaire gauche de morphologie normale (surface X cm2) pluri-folliculaire sans lésion focale.
Absence d’anomalie tubaire décelée.
Cul-de-sac vaginal postérieur fin et régulier (épaisseur < 3 mm).
Absence d’adénomégalie pelvienne.
Absence d’épanchement péritonéal liquidien.
Lame d’épanchement péritonéal du cul-de-sac de Douglas physiologique.
Absence de dilatation des cavités pyélo-calicielles.
Vessie en réplétion sans anomalie pariétale.
CONCLUSION
Absence d’anomalie utérine ou annexielle.
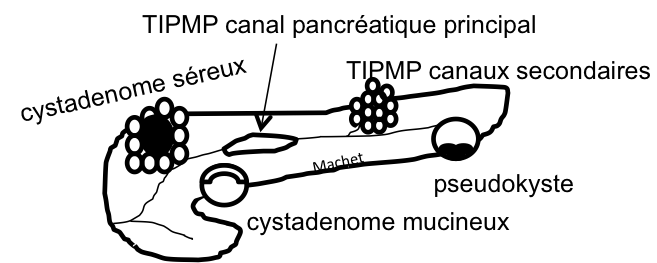
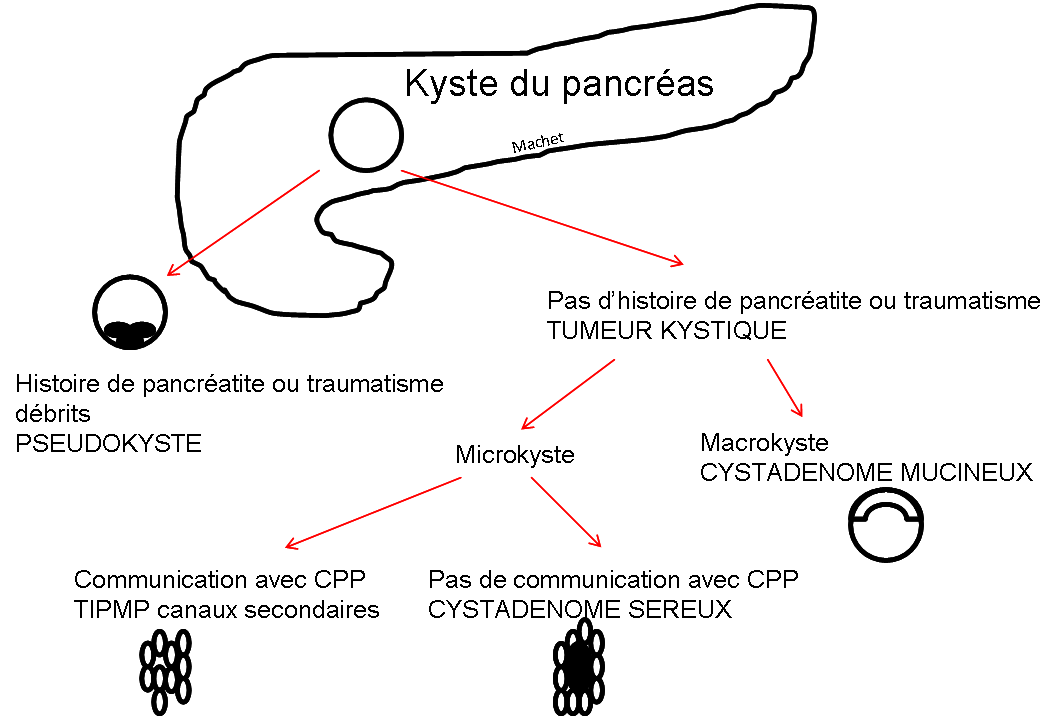

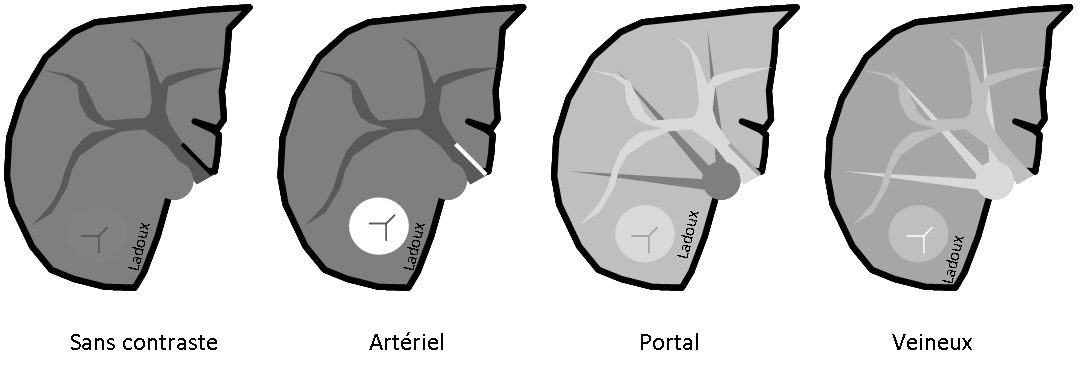


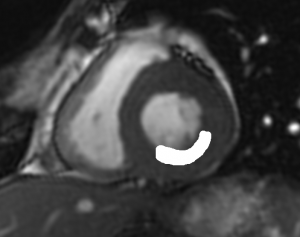
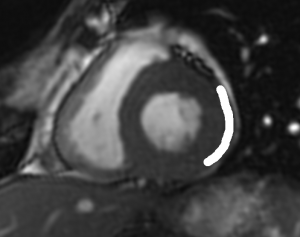
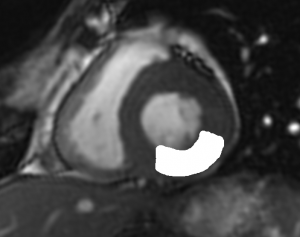
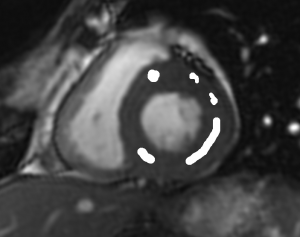
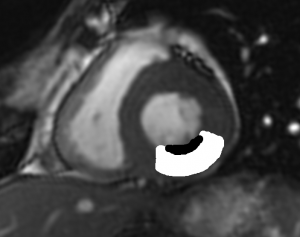
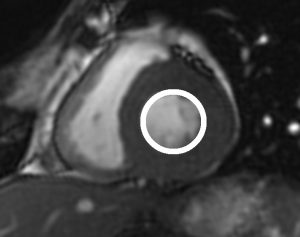

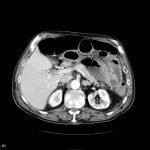
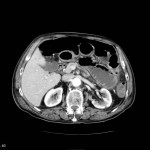
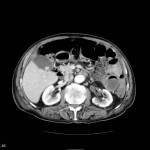
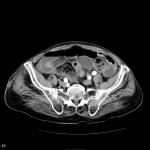
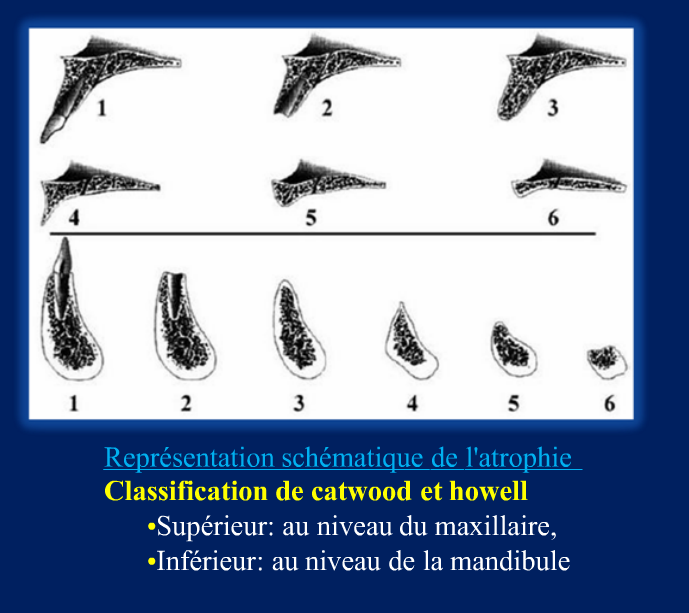
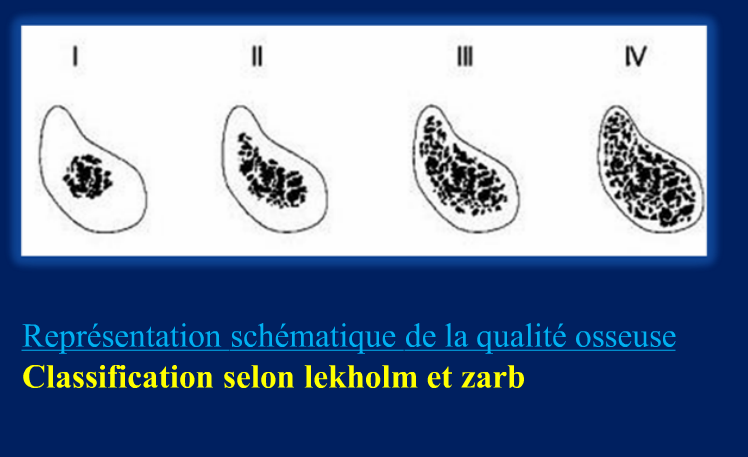

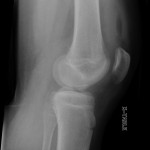
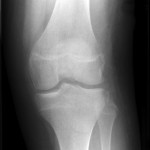
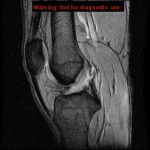
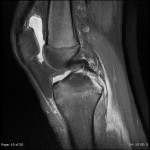
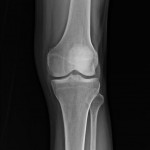
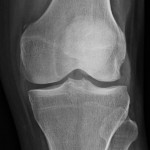
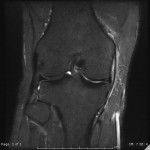
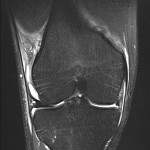
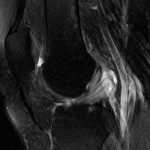
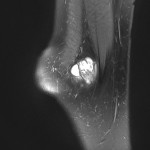
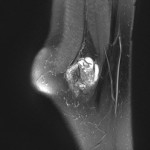
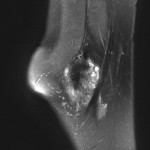
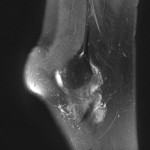
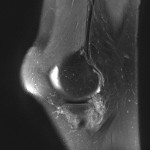
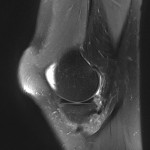
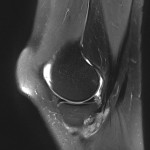
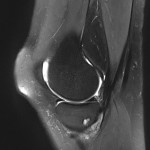
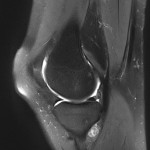
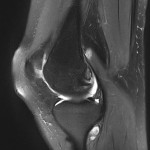
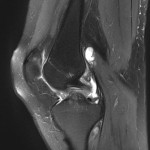
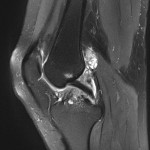
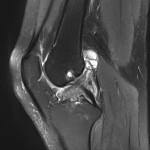
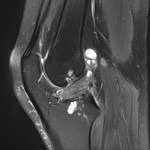
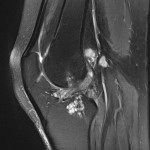
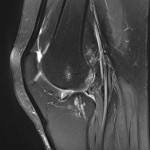
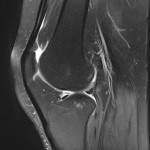
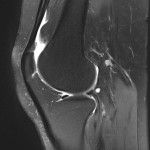
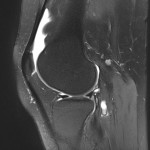
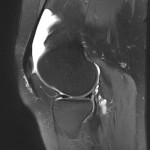
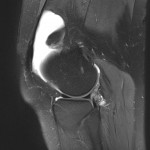
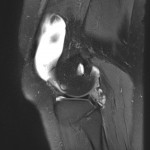
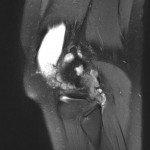
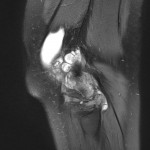
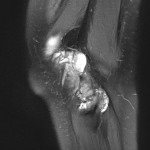
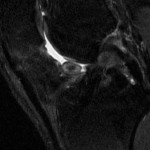
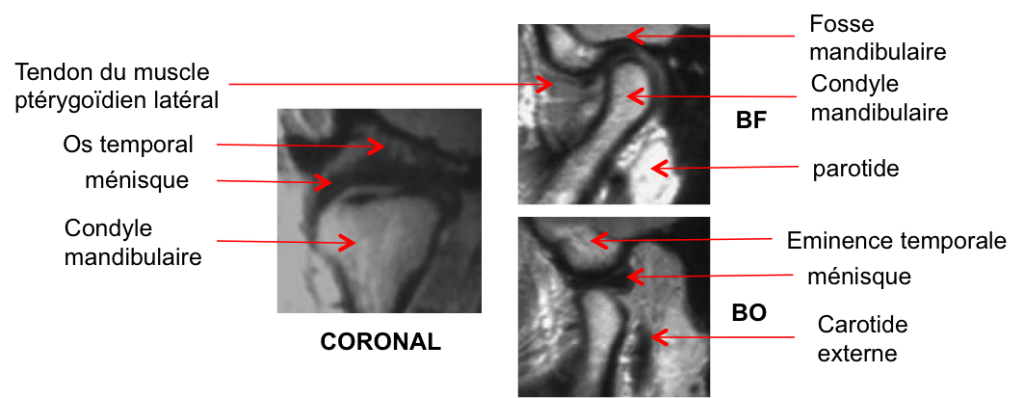
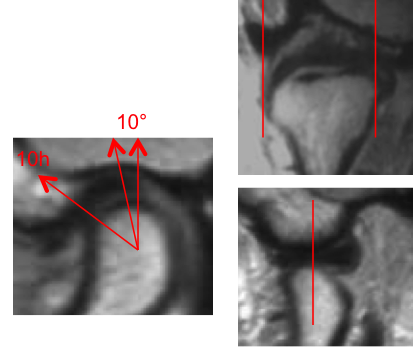
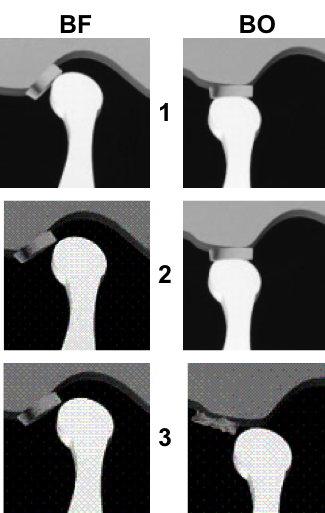 Grade 1 [DCM débutante réductible] : perte de contact condyle et bourrelet antérieur,
Grade 1 [DCM débutante réductible] : perte de contact condyle et bourrelet antérieur,