|
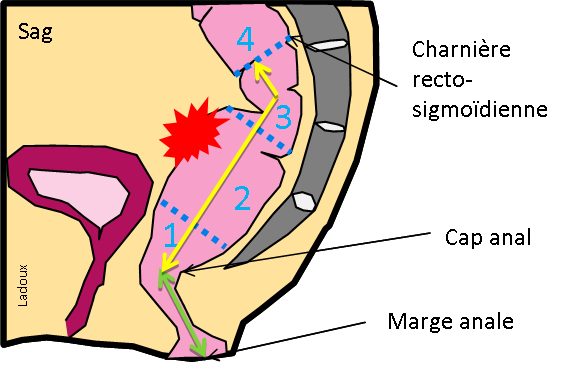
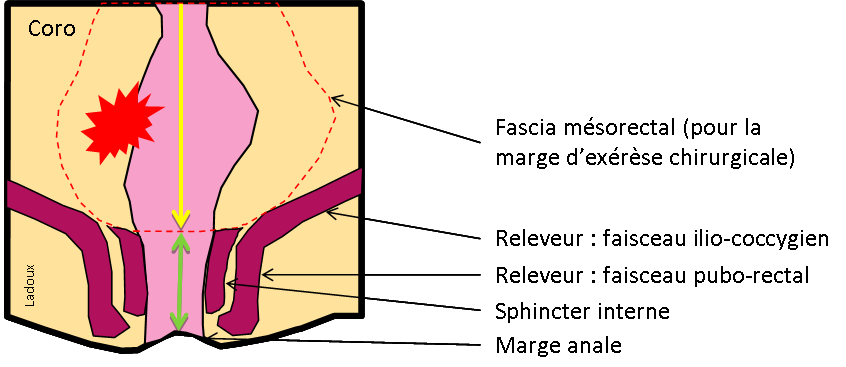
LÉSION |
CARACTÉRISTIQUES |
IMAGERIE |
|
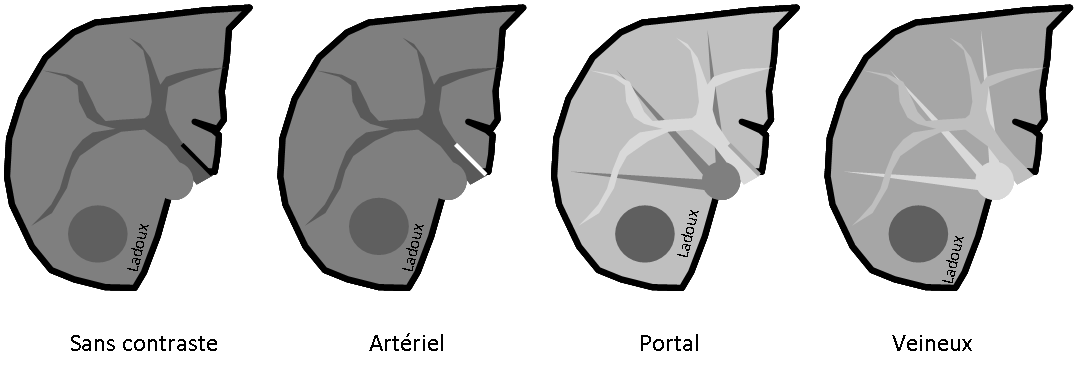
ADÉNOME |
- Lésion bénigne de la corticale
- Non sécrétant : 70%
- sécrétion cortisol : 8%
- Hyperaldostéronisme primaire : 1%
- Hyper métaboliques au TEP : 30% (svt qd pauvre en lipide avec densité > 10 UH)
|
- Bilatéral 15%
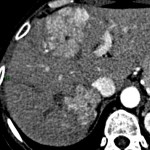
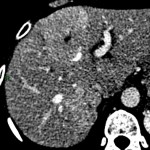
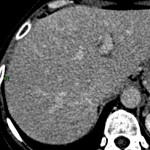
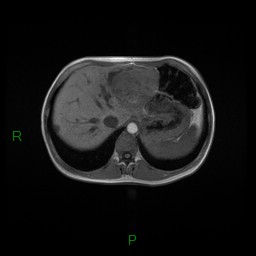
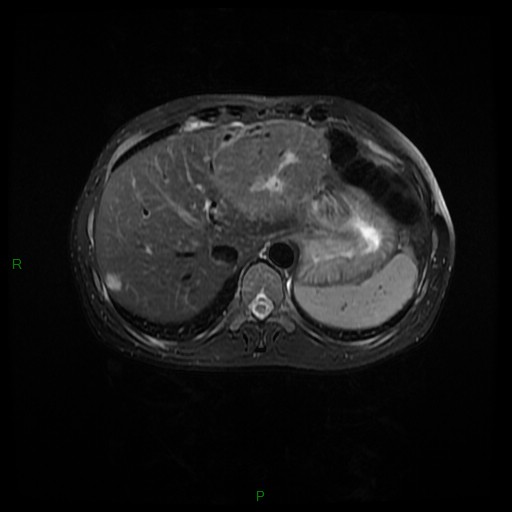
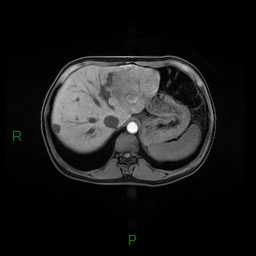
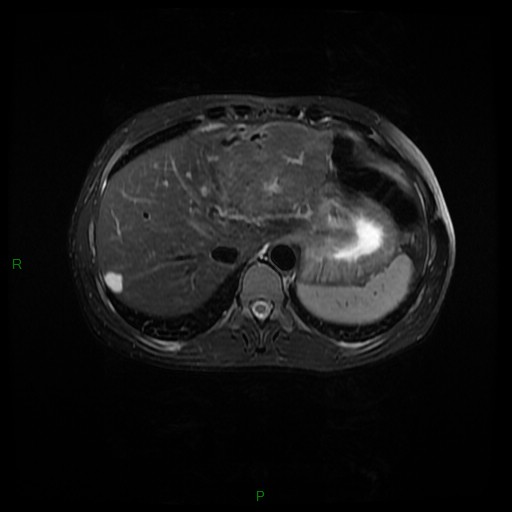
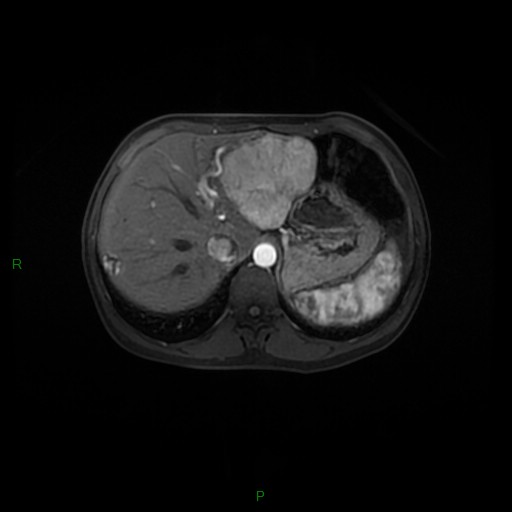
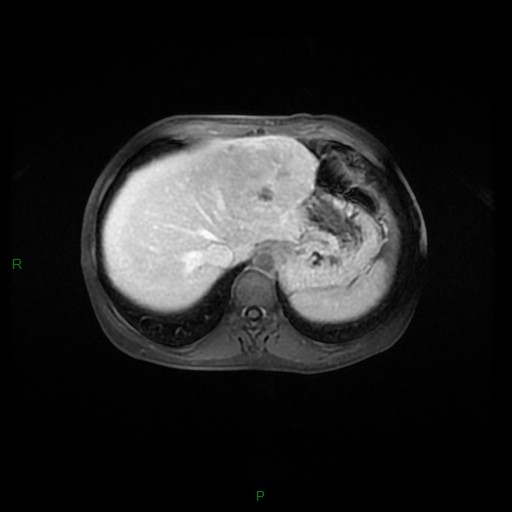
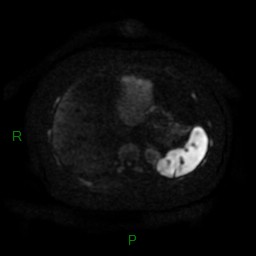
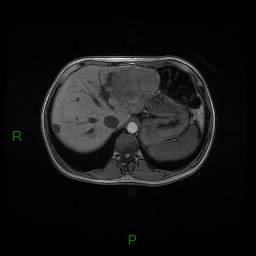
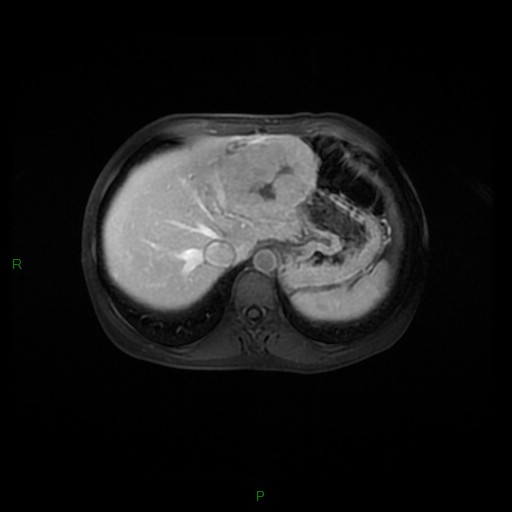
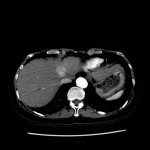
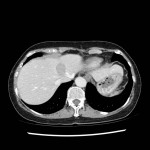
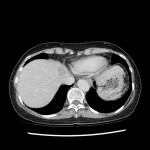
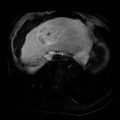
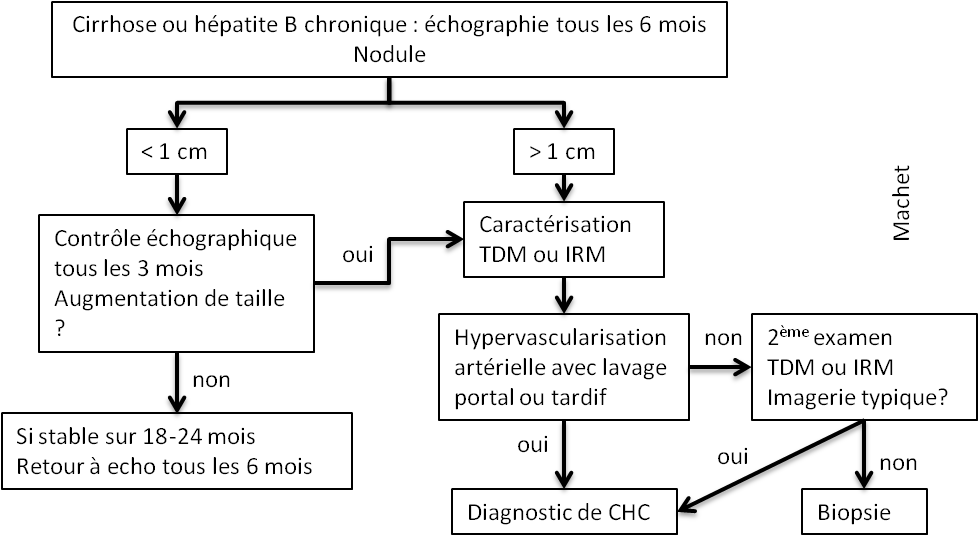
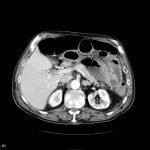
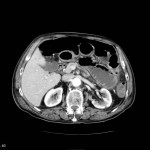
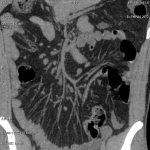
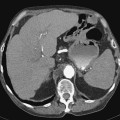
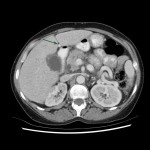
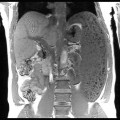
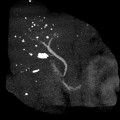
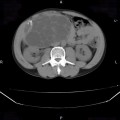
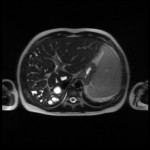
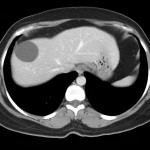
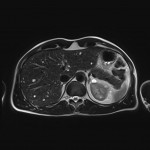
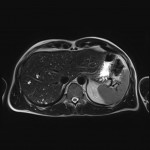
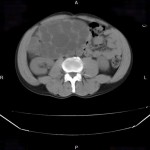
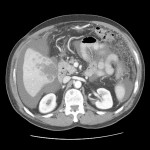
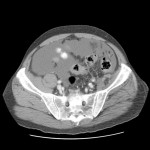
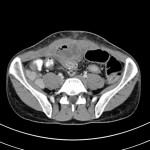
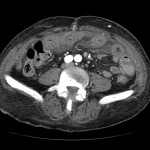
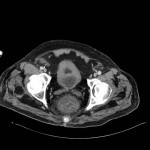
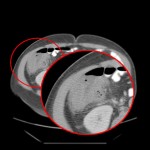
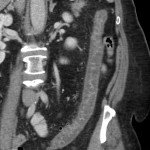
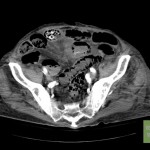
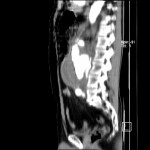
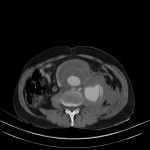
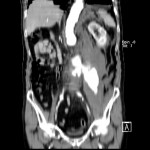
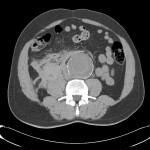
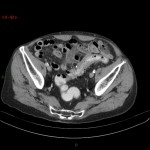
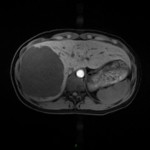
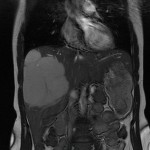
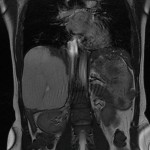
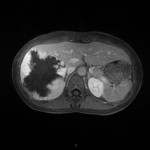
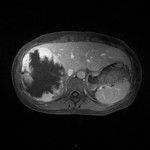
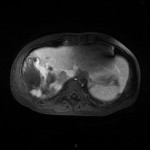
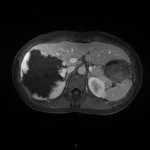
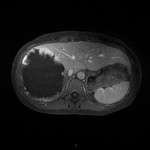
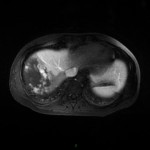
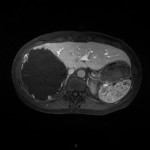
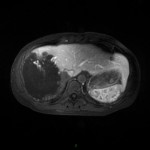
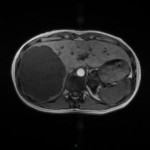
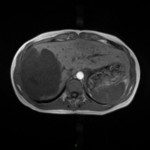
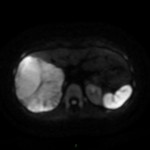
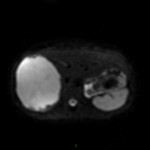
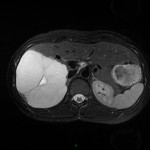
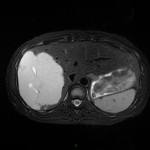
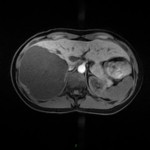
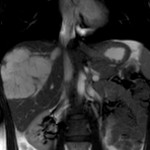
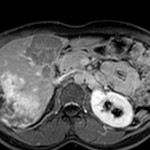
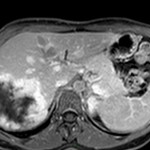
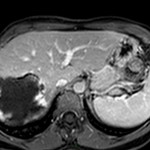
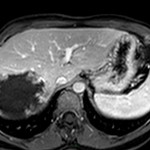
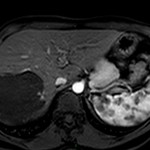
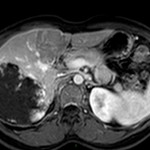
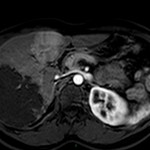
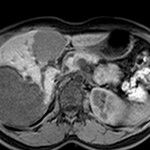
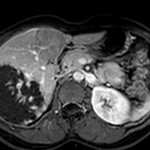
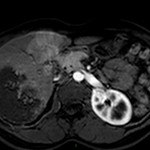
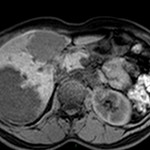
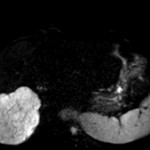
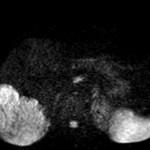
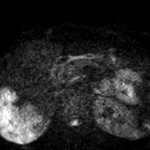
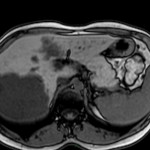
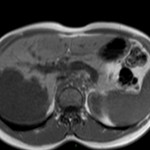
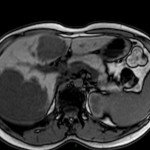
- Rond, homogène, régulier, < 3cm
- Graisse intra-cellulaire :
- Densité spontanée < 10UH
- Chute de signal IPOP > 20%
- Wash out relatif > 40%
|
-
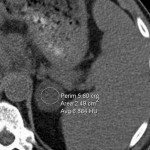
-
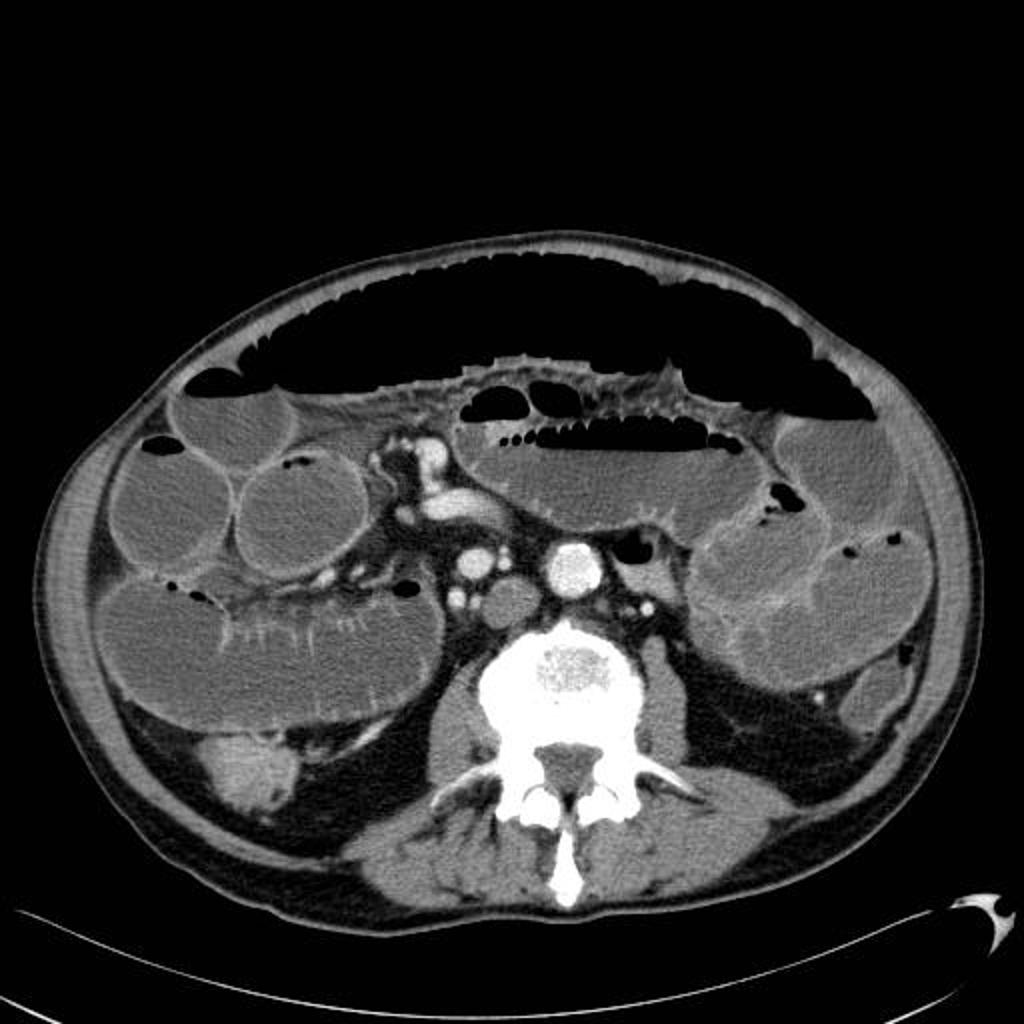
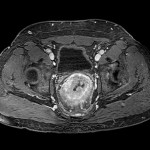
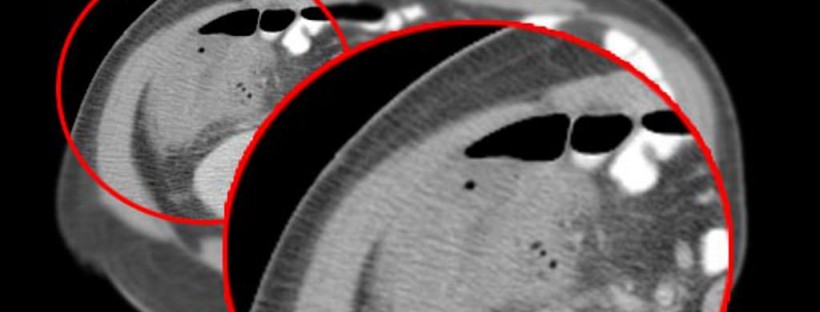
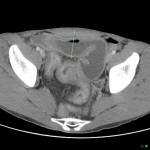
Adénome surrénalien
-
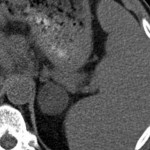
-
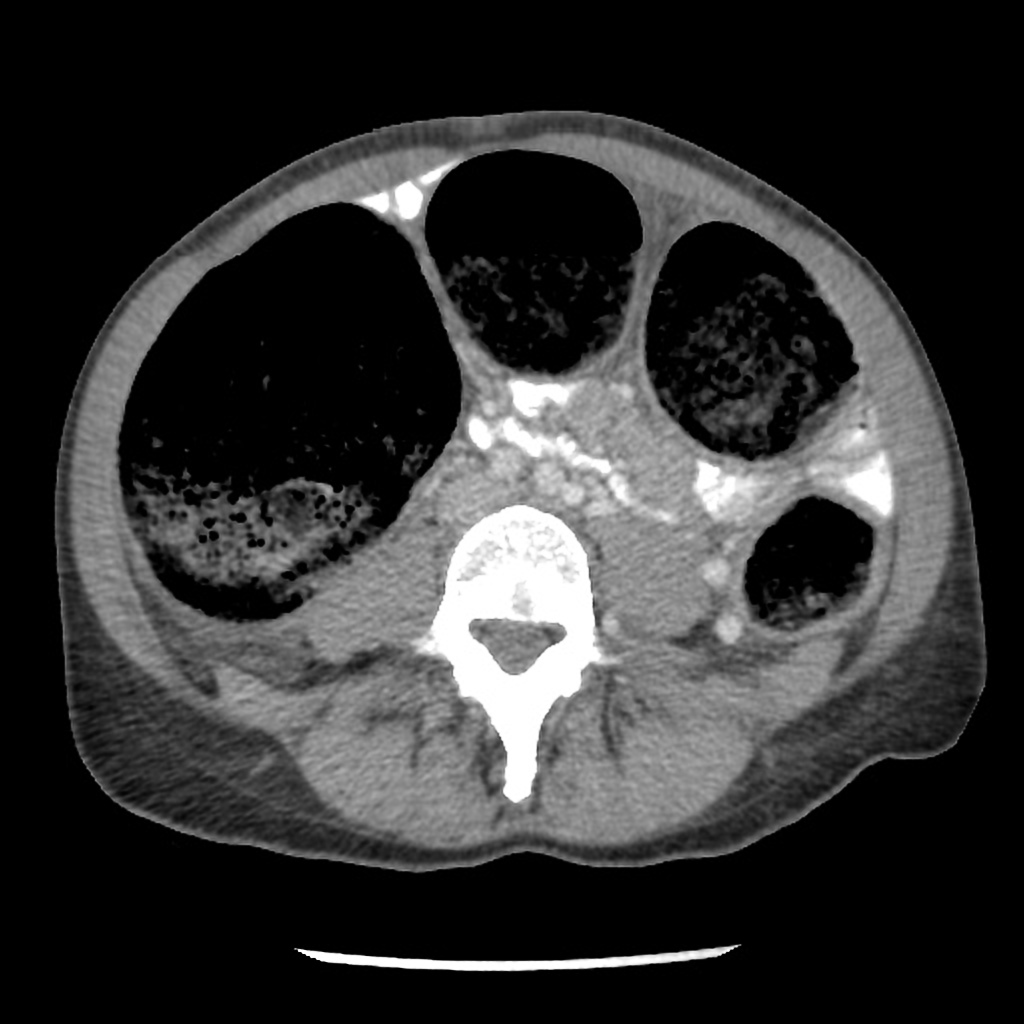
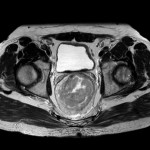
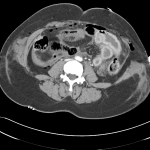
Adénome surrénalien
-
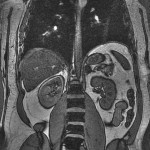
-
Adénome surrénalien
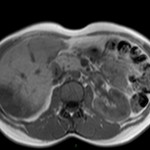
Plus d’images ici |
|
MÉTASTASE |
- Souvent primitif connu : mélanome, poumon, sein, rein, côlon, lymphome, pancréas
|
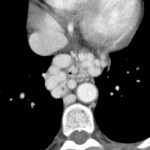
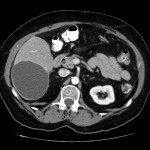
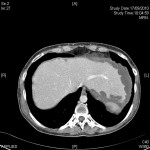
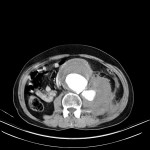
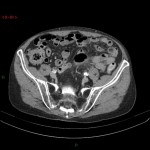
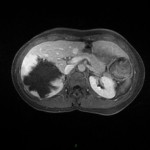
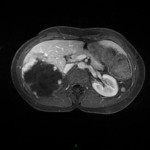
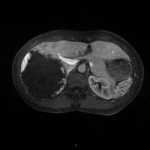
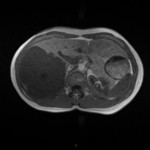
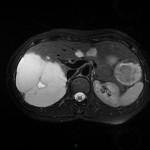
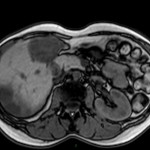
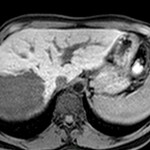
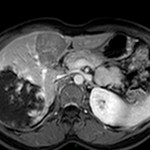
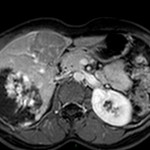
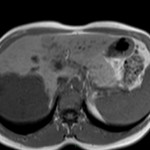
- Souvent bilatéral (30-50%)
- Contours irréguliers, svt >4cm
- Hétérogène avec nécrose/hgie
|
-
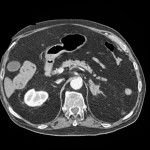
-
Métastase surrénalienne
Plus d’images ici
|
|
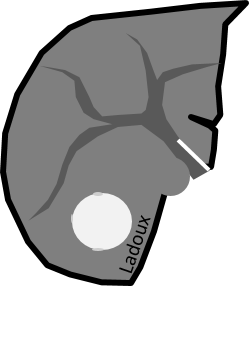
PHÉOCHROMOCYTOME |
- Tumeur de la medullosurrénale
- Triade de Ménard avec HTA (céphalées, palpitations, sueurs)
- Dosage bio : métanéphrines urinaires et plasmatiques
|
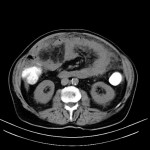
- Non sépcifique
- Svt > 4cm, hétérogène avec nécrose centrale possible
|
-
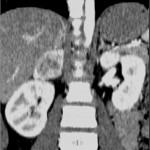
-
Phéochromocytome
-
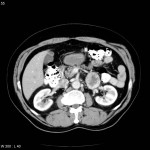
-
Phéochromocytome
-
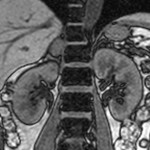
-
Phéochromocytome
Plus d’images ici |
|
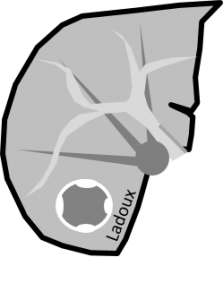
MYELOLIPOME |
- Lésion bénigne de la moelle osseuse
- Tissu graisseux mature
- Possible transformation hémorragique
|
- Plage graisseuse :
- Densité <-30UH
- hyperT1 effacé en FAT SAT
- Ca2+ fréquentes >20%
|
-
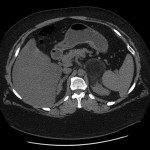
-
Myélolipome surrénalien
-
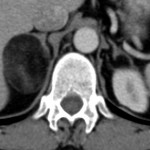
-
Myélolipome surrénalien
Plus d’images ici |
|
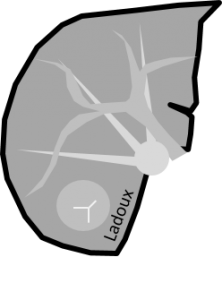
KYSTE |
- Lésion bénigne
- Possible transformation hémorragique
- DDx: schwannome/phéo kystique
|
- Rond, régulier, parois fines, <3cm
- Contenu liquidien :
- Densité spontanée 0-20UH
- HypoT1/hyperT2 liquidien
- Pas de prise de contraste
- Parfois Ca2+ pariétales fines
|
-
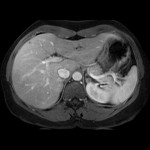
-
Pseudo kyste surrénalien
Plus d’images ici |
|
HÉMATOME |
- Post-traumatique*
- Spontané (anticoagulants, choc septique)
- Lésion préexistante (méta, K, myélolipome)
|
- Aigu
- Hyperdense spontanément
- hyperT1 et T2
- Chronique
- Ca2+ central ou périkystique si non résorbé
|
-
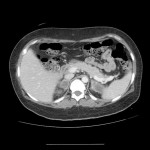
-
Hémorragie surrénalienne
Plus d’images ici |
|
HYPERPLASIE BILATÉRALE DES SURRÉNALES
|
Hyperaldostéronisme primaire |
- Taille
- Harmonieux
- Jambages > 5mm
- Corps > 8mm
- Morphologie
- Bords convexes
- +/- lobulés
|
-
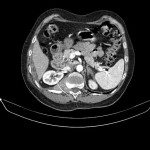
-
Hyperplasie surrénalienne
Plus d’images ici |
|
CORTICOSURRENALOME |
- Tumeur primitive maligne de la corticale
- Adulte jeune 30-50 ans
- Survie à 5 ans <20%
- Sécrétion cortisol fréquente
|
- Bilatérale 5%
- Tissulaire, >4cm, bords irréguliers, hétérogène (nécrose), Ca2+, prise de contraste tissulaire sans lavage
- Métastases: rétropéritonéales, veine cave, foie
|
-
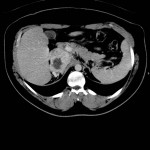
-
Adénocarcinome surrénalien
Plus d’images ici |